
科目: 来源: 题型:
【题目】常温下,酸性溶液A中可能含有NH4+、K+、Na+、Fe2+、Al3+、Fe3+、CO32-、NO3-、Cl-、I-、SO42-中的几种,现取该溶液进行有关实验,实验结果如下图所示:
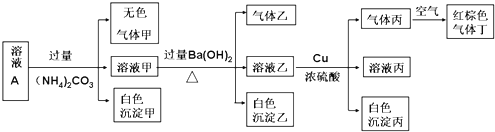
回答下列问题:
(1)溶液A中一定存在的离子有___________________
(2)生成沉淀甲的离子方程式为___________________
(3)生成气体丙的离子方程式为__________________,若实验消耗Cu 144g,则最多生成气体丙的体积(标准状况下)为_____。
依据上述实验,某小组同学通过讨论后认为:溶液中可能含有的离子有NH4+、K+、Na+ 、Cl-、SO42-。为进一步确认溶液中存在的离子,分别取100ml废水又进行了如下图所示的三组实验:

(4)根据上述实验可进一步确定NH4+、K+、Na+ 、Cl-、SO42-中一定存在的离子有 _________ ,沉淀溶解时发生反应的离子方程式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式书写正确的是( )
A. 2SO2 + O2![]() 2SO3 △H= -196.6kJ/mol
2SO3 △H= -196.6kJ/mol
B. N2(g)+2O2(g)=2NO2(g) △H= +67.7kJ/mol
C. C(s)+O2(g)=CO2(g) △H= +393.5kJ/mol
D. H2O(l)==H2(g)↑+1/2O2(g)↑ △H= +285.8kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钾(KCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3=4N2↑+2HNO3+9H2O则被氧化和被还原的氮元素质量之比为________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。若8molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)处理CN一常用的一种方法是用氯气氧化。若某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2 = KOCN+2KCl+H2O 。若投入过量液氯,可将氰酸盐进一步氧化为无毒的N2和CO2。请写出该反应的化学方程式,____,若处理上述废水20 L,使KCN完全转化为无毒物质,至少需液氯_________ g。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质A~I之间能发生如下反应(图中部分反应的条件和产物没有全部标出),其中A,B,C,I为金属单质,B是地壳中含量最多的金属,甲、乙、丙为气体. 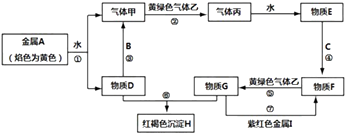
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:C、H .
(2)写出气体甲在气体乙中燃烧的化学方程式:;该反应的现象有: .
(3)写出反应③的化学方程式:;向反应③所得溶液中通入过量的CO2 , 写出反应的离子方程式: .
(4)写出反应⑤的离子方程式:;
(5)检验物质D中阳离子的方法名称是: .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质或离子检验的判断正确的是( )
A.向溶液中滴加酚酞试液,溶液显红色:原溶液是NaOH
B.气体通过无水硫酸铜,粉末变蓝:原气体中含有水蒸气
C.灼烧白色粉末,火焰呈黄色:原粉末是钠盐
D.将气体通入澄清石灰水,溶液变浑浊:原气体是CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】半导体生产中常需要使用掺杂剂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
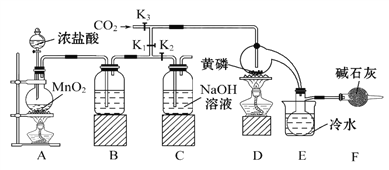
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;②PCl3遇水会强烈水解生成H3PO3和HCl;③PCl3遇O2会生成POCl3,POCl3溶于PCl3;④PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请回答下列问题:
(1)B中所装的试剂是____________________,F中碱石灰的作用是_____________________________________。
(2)实验时,检査装置气密性后,先打开K3、关闭K1,通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是__________,通过控制K1、K2能除去A、B装置中的空气,具体的操作是________________________________。
(3)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过________(填实验操作名称),即可得到较纯净的PCl3。
(4)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00 g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00 mL,向其中加入淀粉作为指示剂
③向其中加入 0.1000 mol·L-1碘水,充分反应,当达到终点时消耗碘水溶液6.9mL。已知:H3PO3+H2O+I2===H3PO4+2HI,假设测定过程中没有其他反应。
滴定时,滴定终点的现象是_________________________________,配制0.1000 mol·L-1的碘水溶液的过程中,下列操作会使所得溶液浓度偏大的是___________
A烧杯中溶液转移至容量瓶中时,未洗涤烧杯
B定容时俯视刻度线
C定容时仰视刻度线
D容量瓶未干燥
E移液时有少量液体溅出
F溶解碘时放热,未冷却至室温就转移至容量瓶并定容
根据上述数据,该产品中PCl3的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组探究溴乙烷的消去反应并验证产物。
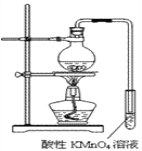
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
(1)实验原理:__________________________________。
(2)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因:_________________________。
(3)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法:______________________________________________________。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(4)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是_______________________________。
(5)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是
①________________________。②___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化。请按要求回答下列相关问题:
(1)SnSO4可使酸性KMnO4溶液褪色,该过程中Sn2+转化为Sn4+,该反应的离子方程式为_______。
(2)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
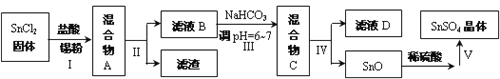
①步骤Ⅰ加入Sn粉的作用: _______________________。
②步骤Ⅱ用到的玻璃仪器有烧杯、_____________________________。
③步骤Ⅲ生成SnO的离子方程式:_________________________。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是____________________,证明已洗净。
⑤步骤Ⅴ由SnSO4溶液得到SnSO4晶体的操作依次为 ________ 、 ________、过滤、洗涤、低温干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com