
科目: 来源: 题型:
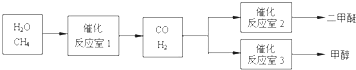
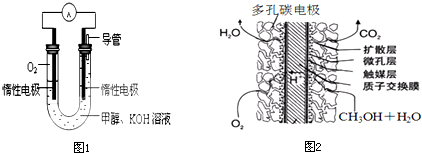
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
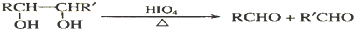





 合成OHC(CH2)2CHO(用反应流程图表示,注明反应物、反应条件;无机试剂可自选).反应流程图示例(由乙醇合成聚乙烯):
合成OHC(CH2)2CHO(用反应流程图表示,注明反应物、反应条件;无机试剂可自选).反应流程图示例(由乙醇合成聚乙烯):
查看答案和解析>>
科目: 来源: 题型:
| 烯经被氧化的部位 | CH2= | RCH= |
 |
| 氧化产物 | CO2 | 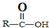 |
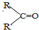 |



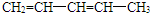
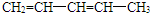


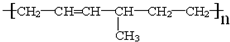
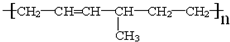
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 物质 | (CH3CO)2O | C6H5CHO | C6H5CH=CHCOOH | CH3COOH |
| 沸点 | 139℃ | 179℃ | 300℃ | 117.9℃ |
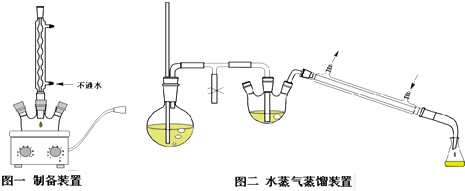


查看答案和解析>>
科目: 来源: 题型:阅读理解
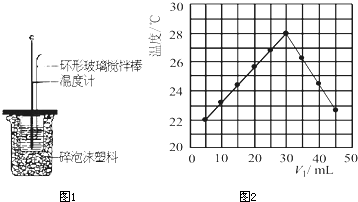
| 温度 | 起始温度t1/℃ | 终止温度 t1/℃ |
温度差 (t2-t1)t1/℃ | ||
| 实验次数 | H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com