
科目: 来源: 题型:
【题目】已知KMnO4 、浓硫酸、双氧水是常见的氧化剂。某小组同学用下图装置做浓硫酸与木炭反应的实验,以及检验生成的CO2和SO2。据此回答下列问题:

(1)木炭与浓H2SO4在加热条件下反应的化学方程式为:__________________________;
(2)装置B观察到的现象是品红溶液褪色,可确定该气体中含有_________________;说明该气体具有___________性;
(3)装置C中紫红色褪去,利用了SO2的还原性,MnO4-被还原为Mn2+,反应的离子方程式为________________________;还原剂与氧化剂的物质的量之比为_________;
(4)装置E观察到的现象是_______________________,该装置中发生的离子方程式是____________________________。
(5)若将装置A中生成的气体通入BaCl2溶液中是否产生沉淀?________(填“是”或“否”),如果通入Ba(NO3)2溶液中产生沉淀的化学式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列数据记录合理的是
A. 用托盘天平称取5.85 g食盐
B. 用10 mL量筒量取8.36 mL稀硫酸
C. 用广泛pH试纸测得某溶液pH值为5.5
D. 用酸式滴定管移取高锰酸钾溶液19.10 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】在烷烃分子中,每增加一个碳原子,每摩尔该烷烃完全燃烧需要多消耗氧气( )
A. 1 mol B. 1.5 mol C. 2 mol D. 2.5 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是
A.苯不能用带橡胶塞的试剂瓶贮存
B.用红色石蕊试纸检测NH3时,需先用蒸馏水润湿
C.碳酸氢钠中混有碳酸钠杂质:加热分解
D.乙酸丁酯(乙酸):加入饱和碳酸钠溶液洗涤,分液
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是一种制取亚氯酸钠的工艺流程:
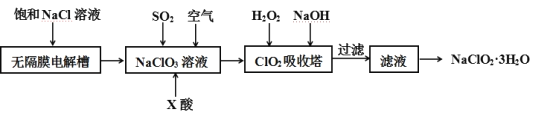
已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出NaClO23H2O。
②ClO2气体只能保持在稀释状态下以防止爆炸性分解,且需现合成现用。
③ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中用惰性电极电解一段时间生成NaClO3和氢气,电解的总反应式为:____________________________________________。 “电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为___________、___________。
(2)发生器中鼓入空气的作用是___________。
(3)吸收塔内反应的化学方程式为___________________________________,吸收塔内的温度不宜过高的原因为:_______________________________。
(4)从滤液中得到NaClO23H2O粗晶体的实验操作依次是____、__________、过滤、洗涤、低温干燥。
(5)经查阅资料可知,当pH≤2.0时,ClO2—能被I—完全还原成Cl—,欲测定成品中NaClO2(M为90.5g/ mol)的含量,现进行以下操作:
步骤Ⅰ | 称取样品Wg于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量的KI晶体,并加入少量的指示剂 |
步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定,生成I—和S4O62— |
①步骤Ⅱ中发生反应的离子方程式是_______________________________________。
②若上述滴定操作中用去了VmL Na2S2O3溶液,则样品中NaClO2的质量分数为:__________(用字母表示,不用化简)。(已知2Na2S2O3+I2=Na2S4O6+2NaI)
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物在工农业上有重要作用。
Ⅰ、在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___________。该反应为__________(填“吸热”或“放热”)反应。
(2)某温度下平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),该温度下加入1 mol CO2(g)和1 mol H2(g),充分反应,达到平衡时,CO2的转化率为______________。
(3)在800 ℃时发生上述反应,某时刻测得容器内各物质的浓度分别为c(CO2)为2 mol/L,c(H2)为1.5 mol/L,c(CO)为1 mol/L,c(H2O)为3 mol/L,则正、逆反应速率的比较为:v正___________v逆(填“>”“<”或“=”)。
Ⅱ、工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJmol-1
CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJmol-1
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H3=_______________kJ·mol-1。
CH3OCH3(g)+3H2O(g)△H3=_______________kJ·mol-1。
Ⅲ、常温下用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c(NH4+)________(填“>”、“<”或“=”)c(HCO3—);反应NH4++HCO3—+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g)+ H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
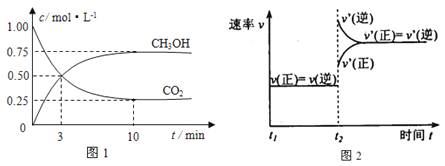
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=___________________。
(2)500℃该反应的平衡常数为__________(结果保留一位小数),图2是改变温度时化学反应速率随时间变化的示意图,若提高温度到800℃进行,达平衡时,K值___________(填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是________________。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂 E.将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)______ v(逆)(填“>”“<”或“=”)。
Ⅱ、一定条件下,可逆反应A2(g)+B2(g) ![]() 2C(g)达到平衡时,各物质的平衡浓度为c(A2)=0.5mol/L;c(B2)=0.1mol/L;c(C)=1.6mol/L。若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:
2C(g)达到平衡时,各物质的平衡浓度为c(A2)=0.5mol/L;c(B2)=0.1mol/L;c(C)=1.6mol/L。若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:
①a、b应满足的关系是__________; ②a的取值范围是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com