
科目: 来源: 题型:
【题目】Ⅰ、A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):试回答:
![]()
(1)若D是具有氧化性的单质,A为金属且属于主族,写出B和D生成C 的化学方程式_________________________。
(2)若D是金属,A是强酸,写出A和D生成B的化学方程式______________;且A和C可生成B,写出该离子方程式______________________________。
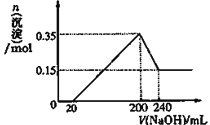
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B,写出该反应的离子方程式_________。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E 的混合物投入200mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示 。则固体混合物中E的质量为______,H2SO4溶液的物质的量浓度为_______mol/L。
Ⅱ、含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO![]() 还原为N2 ,从而消除污染。其反应的离子方程式是:6NO
还原为N2 ,从而消除污染。其反应的离子方程式是:6NO![]() +10Al+18H2O=3N2↑+10Al(OH)3+6OH-
+10Al+18H2O=3N2↑+10Al(OH)3+6OH-
(1)上述反应中,生成标准状况下5.6L氮气时,转移的电子为___________mol;
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
①写出镁和含氮废水反应的离子方程式_________________________________;
②已知金属镁可以从海水中提取的MgCl2通过电解制得的,若要除去1m3含氮元素0.2mol的废水中的NO![]() (设氮元素都以NO
(设氮元素都以NO![]() 的形式存在),则至少需要含0.5%(质量分数)MgCl2的海水___________kg。
的形式存在),则至少需要含0.5%(质量分数)MgCl2的海水___________kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. H2O2中加入MnO2, 产生O2的速度加快
C. 3H2 (g)+N2 (g) ![]() 2NH3 (g),ΔH< 0反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
2NH3 (g),ΔH< 0反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
D. 氨水应密闭保存、放置于低温处
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是( )
A. 1mol葡萄糖与足量的钠反应能产生2.5mol H2
B. a g某气体中含分子数为b,c g该气体在标况下的体积为(22.4bc)/(aNA)
C. 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-) =2NA(N表示粒子数)
D. 相同质量的Na2O2和Na2S固体具有相同的阴阳离子数和质子数
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关元素的性质及其递变规律正确的是( )
A.IA族与ⅦA族元素间形成的化合物都是离子化合物
B.第三周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,其单质的氧化性越强
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X,Y,Z,W,Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( ) 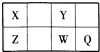
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
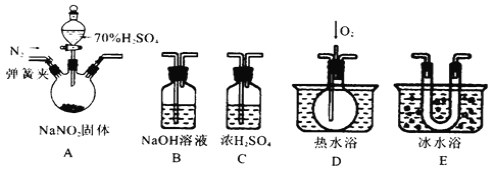
已知:① NO+NO2+2OH-=2NO2-+H2O
② 气体液化的温度:NO2(21℃)、NO(–152℃)
(1)反应前应打开弹簧夹,先通入一段时间氮气,目的是________________________。
(2)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→_____________;组装好仪器后,接下来进行的操作是________________。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后,A中产生红棕色气体。
① 确认A中产生气体含有NO,依据的现象是_____________________________。
② 装置E的作用是_______________________________________________________。
(4)如果没有装置C,对实验结论造成的影响是______________________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,对可逆反应A (g) + B (g) ![]() 3C (g)的下列叙述中,不能说明反应已达到平衡的是( )
3C (g)的下列叙述中,不能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗a mol A,同时生成3a mol C
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】实验探究:探究碳、硅元素的非金属性的相对强弱.根据要求完成下列各小题.
(1)实验装置: 
填写所示仪器名称AB
(2)实验步骤:
连接仪器、、加药品后,打开a、然后滴入浓硫酸,加热.
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是;装置E中足量酸性KMnO4溶液(具有强氧化性)的作用是;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性(填“能”或“否”),试管D中发生反应的离子方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO- + H+,对于该平衡,下列叙述正确的是( )
CH3COO- + H+,对于该平衡,下列叙述正确的是( )
A. 加入少量CH3COONa固体,平衡正向移动
B. 加入少量NaOH固体,平衡正向移动
C. 加入少量0.1mol/L HCl溶液,溶液中c(H+)减小
D. 加入水,平衡逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com