
科目: 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液,滴加过程中溶液中-lgc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )
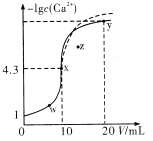
A. z点对应的分散系很稳定
B. w、x、y三点中,水的电离程度最大的为y点
C. 若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
D. Ksp(CaCO3)=5×10-10mol2/L2
查看答案和解析>>
科目: 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种.若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀.
A. ①④⑥ B. ②③⑤ C. ②③④ D. ①③④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是应用广泛的金属,以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是___________________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。

其中,离子交换膜使用的是__________(阳离子交换膜、阴离子交换膜),阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
I.称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;
II.用微孔玻璃漏斗(无需滤纸)过滤除去难溶的MnO(OH)2;
III.过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
IV.利用氧化还原滴定方法,在70℃-80℃条件下用H2C2O4溶液测定KMnO4浓度。
已知:MnO4-(H+)→Mn2+、H2C2O4→CO2 反应中其他元素没有得、失电子。则
(1)在硫酸酸化的条件下,KMnO4与H2C2O4反应的离子方程式是____________________;
(2)步骤IV保证在70℃-80℃条件下进行滴定,可采用的方法是:_________;实验中需要准确测量消耗KMnO4溶液的体积,应选择___________________作为盛装KMnO4溶液所使用的仪器;
(3)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,滴定终点标志应为________,此时记录消耗高锰酸钾溶液的体积。若多次平行滴定测得需要消耗KMnO4溶液的平均体积为v mL,计算c(KMnO4)=________mol·L-1;下图表示使用50mL滴定管到达滴定终点时液面的位置,若A与C刻度间相差1 mL,A处的刻度为25,滴定管中液面读数应为______mL。

(4)以下操作造成标定高锰酸钾溶液含量偏高的原因可能是________________________。
A.滴定时控制速度过快,到达终点后多滴加入KMnO4溶液
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装草酸溶液的锥形瓶用蒸馏水洗过,未用草酸溶液润洗
D.滴定过程中少量草酸溶液洒到锥形瓶外
E.用放置两周的KMnO4溶液去滴定草酸溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定反应速率(药品:稀硫酸、Na2S2O3溶液等)。
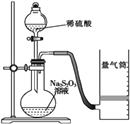
(1)除如图装置所示的实验用品外,还需要的一件实验仪器用品是________________;请写出在圆底烧瓶中所发生反应的离子方程式为___________________________________________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(3)利用该化学反应,试简述测定反应速率的其他方法:___________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知 I2+2 Na2S2O3= Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(4)表中Vx=__________mL,该实验中加入淀粉的目的为_______________________;请判断T1、T2、T3的大小关系,并总结实验所得出的结论__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列溶液中c(H+)最小的是
A.pH=0的溶液B.0.03 mol·L-1H2SO4
C.0.05 mol·L-1HClOD.0.05 mol·L-1的NaHSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于硅和二氧化硅的说法中不正确的是
A. 硅和二氧化硅都是熔沸点很高、硬度很大的物质
B. 硅和二氧化硅都能与强碱(如氢氧化钠)溶液反应
C. 硅和二氧化硅都能与硫酸、硝酸反应
D. 硅晶体和二氧化硅都由原子构成
查看答案和解析>>
科目: 来源: 题型:
【题目】关于A1(OH)3的说法正确的是
A. 只能与盐酸反应 B. 既不能与盐酸反应又不能与氢氧化钠溶液反应
C. 能与氢氧化钠溶液反应 D. 既能与盐酸反应又能与氢氧化钠溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com