
科目: 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。

(1)仪器A的名称是________________。安装F中导管时,应选用图2中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜__________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是________________________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_________________________。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是_________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是_____________,
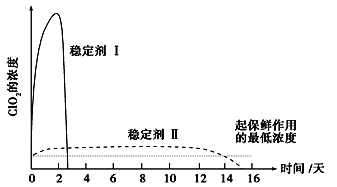
理由:_____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能源、环境与生产生活和社会发展密切相关。
一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2(g)和3 mol H2(g) | 32g CH3OH(g)和18g H2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4 kJ | 吸收a kJ |
(1)c1____(填“>”、“<”或“=”)c2,a=____。
(2)该反应的平衡常数表达式为K=____;若甲中反应10 s 时达到平衡,则0~10 s内甲中的平均反应速率v(H2)=______。
(3)下列情况能说明该反应一定达到平衡状态的是____(填字母)。
a. v(CO2)消耗=v(CH3OH)生成 b. 气体的密度不再随时间改变
c. CO2和CH3OH的浓度之比不再随时间改变 d. 气体的平均相对分子质量不再随时间改变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂 B. 工业上电解熔融状态的Al2O3制备Al
C. 工业上利用合成氨实现人工固氮 D. 实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目: 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
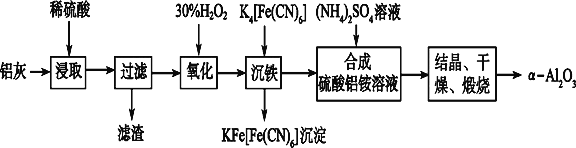
(1)写出铝灰与氢氧化钠溶液反应涉及的化学方程式:_____________________。
(2)图中“滤渣”的主要成分为_______________(填化学式)。
(3)加30%H2O2溶液发生的离子反应方程式为___________________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
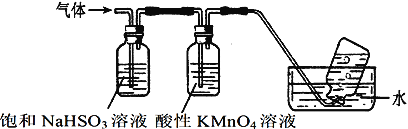
①集气瓶中收集到的气体是___________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有____________(填化学式)。
③酸性KMnO4溶液紫色变浅_________(填“能”或“不能”)说明煅烧硫酸铝铵晶体产物中含有SO2气体?
理由:_________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学方程式为____________________。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NH3在标准状况下是____L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NH3在标准状况下是____L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH = -196.6 kJ·mol-1
2SO3(g) ΔH = -196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH = -113.0 kJ·mol-1
2NO2(g) ΔH = -113.0 kJ·mol-1
①则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO2
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=____。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。

该反应的ΔH ____(填“>”或“<”)0。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________________。
(4)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx,可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) ═ N2(g)+CO2(g)+2H2O(g) ΔH = -867 kJ·mol-1
2NO2(g)![]() N2O4(g) ΔH = -56.9 kJ·mol-1
N2O4(g) ΔH = -56.9 kJ·mol-1
H2O(g)![]() H2O(l) ΔH = -44 kJ·mol-1
H2O(l) ΔH = -44 kJ·mol-1
写出CH4 催化还原N2O4(g) 生成N2(g)、CO2(g) 和H2O(l)的热化学方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识完成题目:
(1)H2SO4的摩尔质量为;0.3mol的NH4+中含有个电子;
(2)①标准状况下22.4L CH4 ②1.5mol NH3 ③1.806×1024个H2O ④标准状况下73g HCl所含H原子个数由多到少的顺序为(填序号);
(3)在含0.4mol Al2(SO4)3的溶液中SO42﹣的物质的量为;
(4)某常见气体在标准状况下的密度为1.25g/L,若该气体的分子式为A2型,则其名称是;
(5)取100mL a mol/L HCl溶液与300mL n mol/L H2SO4溶液均注入到500mL的容量瓶中,加水稀释到刻度线,则该混合溶液中H+的物质的量浓度为mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com