
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
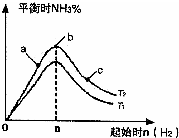 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:



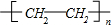
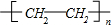
| Cu |
| △ |
| Cu |
| △ |
| △ |
| △ |
查看答案和解析>>
科目: 来源: 题型:
 完成以下实验:①用如图1所示的装置制取溴乙烷;②进行溴乙烷的性质实验.在试管I中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.试回答下列问题:
完成以下实验:①用如图1所示的装置制取溴乙烷;②进行溴乙烷的性质实验.在试管I中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.试回答下列问题:| △ |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com