
科目: 来源: 题型:
【题目】铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等,回答下列问题:
(1)铅与碳是同族元素,则下列说法正确的是 .
a.主要化合价为+2,+4
b.同族的Si与Ge(锗)均为半导体材料,铅也为半导体材料.
c.铅的最高价氧化物对应水化物的酸性强于碳酸
d.与同族的Ge(锗)作比较:碱性Ge(OH)4<Pb(OH)4 , 则金属性Ge<Pb,周期表中位置Pb在Ge下面.
e.同族的Ge(锗)与盐酸不反应,Pb与盐酸能反应,则原子半径Ge>Pb
(2)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 .
(3)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g)△H=a kJmol﹣1
PbS(s)+2PbO(s)=3Pb(s)+SO2(g)△H=b kJmol﹣1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g)△H=c kJmol﹣1
反应3PbS(s)+6O2(g)=3PbSO4(s)△H=kJmol﹣1(用含a,b,c的代数式表示).
(4)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图1所示,该电池正极的电极反应式为 . 
(5)PbO2在加热过程发生分解的失重曲线如图2所示,已知失重曲线上的a点为样品失重4.0%[即:( ![]() ×100%]的残留固体.若a点固体组成表示为PbOx或mPbO2nPbO,列式计算x值 , 和m:n值 .
×100%]的残留固体.若a点固体组成表示为PbOx或mPbO2nPbO,列式计算x值 , 和m:n值 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.乙醇与乙酸能发生酯化反应
B.乙酸乙酯的水解反应属于取代反应
C.乙烯和苯均能与酸性KMnO4溶液发生加成反应而使酸性KMnO4溶液退色
D.加成反应和加聚反应的原子利用率均为100%
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4nH2O).
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是 .
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.
①在101KPa时,1.6g CH4(g)与H2O(g)反应生成CO、H2 , 吸热20.64kJ.则甲烷与H2O(g)反应的热化学方程式: .
②CH4不完全燃烧也可制得合成气:CH4(g)+ ![]() O2(g)═CO(g)+2H2(g);
O2(g)═CO(g)+2H2(g);
△H=﹣35.4kJmol﹣1 . 则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为(填序号);原因是 .
(3)利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)=CO(g)+H2O(g)△H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C≡O | H﹣O | C﹣H |
E/(kJmol﹣1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算△H1=kJmol﹣1 , 已知△H2=﹣58kJmol﹣1 , 则△H3=kJmol﹣1 .
(4)可燃冰中CH4的其它用途是,将CH4设计成燃料电池,其利用率更高,装置示意图(A、B为多孔性碳棒).持续通人甲烷,在标准状况下,消耗甲烷体积VL.
①O<V≤44.8L时,电池总反应方程式为 ,
②44.8L<V≤89.6L时,负极电极反应为 . 
查看答案和解析>>
科目: 来源: 题型:
【题目】已知酸性:![]() 综合考虑反应物的转化率和原料成本等因素,将
综合考虑反应物的转化率和原料成本等因素,将![]() 转变为
转变为![]() 的最佳方法是( )
的最佳方法是( )
A. 与稀H2SO4共热后,加入足量NaOH溶液
B. 与稀H2SO4共热后,加入足量NaHCO3溶液
C. 与足量的NaOH溶液共热后,再加入适量H2SO4
D. 与足量的NaOH溶液共热后,再通入足量CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是18×7的格子,按要求作答
A | He | ||||||||||||||||
G | C | D | |||||||||||||||
B | E | F | I | H | |||||||||||||
Fe | Cu | ||||||||||||||||
(1)用封闭的实线绘出元素周期表的轮廓,注意:不得使用铅笔作图.
(2)C元素的一种中子数为10的同位素的原子符号为 , C2﹣的离子结构示意图为 , C,D,E,F的简单离子半径由小到大顺序是 . (填写离子符号 )
(3)A,G,C中的2种或3种元素能形成18个电子的分子、(填化学式),其中A,G也能形成GA5的离子化合物(填电子式).
(4)请分别用1个离子方程式说明B和F的金属性强弱: , C和D的非金属性强弱 .
(5)Fe位于周期表周期族,请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱.写出总反应式:负极电极反应式: , 并在方框内画出实验装置图,并标注电极材料和电解质溶液. 
查看答案和解析>>
科目: 来源: 题型:
【题目】(双选)4-溴甲基-1-环已烯的一种合成路线如下:
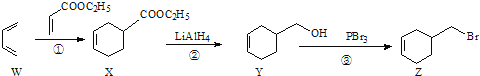
下列说法正确的是( )
A. 化合物X、Y、Z中均有一个手性碳原子
B. ①、②、③的反应类型依次为加成反应、还原反应和取代反应
C. 由化合物Z一步制备化合物Y的转化条件是:NaOH醇溶液,加热
D. 化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2molL﹣1 , 溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( ) 
A.电池工作时,盐桥中的SO42﹣移向乙烧杯
B.石墨b的电极反应式为Fe2+﹣e﹣═Fe3+
C.当有0.1 mol SO42﹣进入烧杯时,反应消耗H+0.2 mol
D.当 MnSO4浓度变为2.2 molL﹣1时,反应中转移电子0.2 mol(不考虑溶液的体积变化)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量.其他相关数据如表:
O═O | H﹣H | H﹣O(g) | |
1 mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
则表中x为( )
A.920
B.557
C.463
D.188
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( )
A.该装置将化学能转化为电能
B.催化剂b表面O2发生还原反应,其附近酸性增强
C.催化剂a表面的反应是:SO2+2H2O﹣2e﹣=SO42﹣+4H+
D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com