
科目: 来源: 题型:
【题目】a mol Fe3O4与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为
A. 62(a+b) g B. 186(a+b) g
C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某品牌化妆品的主要成分Z具有美白功效,原从杨树中提取,现可用如下图所示反应合成。下列对X、Y、Z的叙述,正确的是
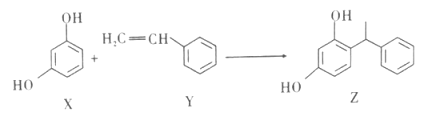
A. X、Y和Z均能和NaOH溶液反应
B. X和Z均能和Na2CO3溶液反应,但不能和NaHCO3溶液反应
C. Y既能发生加聚反应,也能发生缩聚反应
D. Y分子中所有原子不可能共平面
查看答案和解析>>
科目: 来源: 题型:
【题目】利用反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A. 降低温度 B. 增大压强
C. 升高温度同时充入N2 D. 及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是基础化工的重要产品,硫酸的消费量可作为衡量一个国家工业发展水平的标志。生产硫酸的主要反应为:SO2(g)+ 1/2O2(g) ![]() SO3(g)。
SO3(g)。
(1)恒温恒压下,平衡体系中SO3的体积分数和y与SO2、O2的物质的量之比的关系如图1:则b点n(SO2)/n(O2)=________________;y为_____________(填编号)。
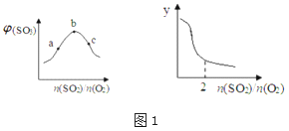
A.平衡常数
B.SO3的平衡产率
C.O2的平衡转化率
D.SO2的平衡转化率
(2)Kp是以各气体平衡分压代替浓度平衡常数Kc中各气体的浓度的平衡常数。在400~650℃时,Kp与温度(T /K)的关系为lgKp= - 4.6455,则在此条件下SO2转化为SO3反应的ΔH_______(填“>0”或“<0”)。
(3)①该反应的催化剂为V2O5,其催化反应过程为:
SO2+V2O5![]() SO3+V2O4 K1 1/2O2+V2O4
SO3+V2O4 K1 1/2O2+V2O4![]() V2O5 K2
V2O5 K2
则在相同温度下2SO2(g)+O2(g) ![]() 2SO3(g)的平衡常数K=____________(以含K1、K2的代数式表示)。
2SO3(g)的平衡常数K=____________(以含K1、K2的代数式表示)。
②V2O5加快反应速率的原因是_____________________________。
(4)在7.0% SO2、11% O2、82% N2(数值均为气体体积分数)时,SO2平衡转化率与温度、压强的关系如图2,则列式计算460℃、1.0 atm下,SO2(g)+1/2 O2(g) ![]() SO3(g)的Kp=_______(已知:各气体的分压=总压×各气体的体积分数)。
SO3(g)的Kp=_______(已知:各气体的分压=总压×各气体的体积分数)。

(5)综合第(4)题图给信息,工业生产压强通常采用常压的原因是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是工业生产硝酸铵的流程图. 
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式: .
(2)B装置中Pt﹣Rh合金网的作用是
(3)写出B中的反应方程式: .
(4)写出D中的反应方程式: .
(5)吸收塔C中通入空气的目的是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. 
根据判断出的元素回答问题:
(1)y在周期表中的位置是 .
(2)比较d、e常见离子的半径大小(用化学式表示,下同):;比较g、h的最高价氧化物对应水化物的酸性强弱 .
(3)任选上述元素组成2种四原子共价化合物,写出其电子式:; .
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中发生反应:M(g)+2N(g)![]() xP(g) ΔH<0,N、P的物质的量随时间变化的关系如图所示。下列有关说法不正确的是( )
xP(g) ΔH<0,N、P的物质的量随时间变化的关系如图所示。下列有关说法不正确的是( )
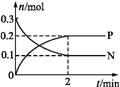
A. x=2
B. 反应开始2 min内,v(P)=0.1 mol·L-1·min-1
C. 2 min后,降低温度平衡向右移动
D. 当容器内混合气体压强不再改变时,反应体系达到化学平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】实验中需用2.0molL﹣1的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为( )
A.950 mL;201.4 g
B.1 000 mL;212.0 g
C.100 mL;21.2 g
D.500 mL;100.7 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com