
科目: 来源: 题型:
【题目】能源问题日益成为制约国际社会经济发展的瓶颈。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为2l世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
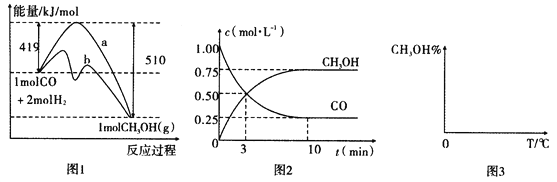
请回答下列问题:
(1)在“图1”中,曲线_____(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是______________。
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大
(3)从反应开始到建立平衡,v(H2)=__________;该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为___________。若保持其他条件不变,向平衡体系中再充入0.5mol CO、lmolH2、1.5 molCH3OH,此反应进行的方向为____________(填“正反应方向”或“逆反应方向)”。
CH3OH(g)的化学平衡常数为___________。若保持其他条件不变,向平衡体系中再充入0.5mol CO、lmolH2、1.5 molCH3OH,此反应进行的方向为____________(填“正反应方向”或“逆反应方向)”。
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线__________(在曲线上标出p1、p2,且p1>p2)。
(5)科学家常用量热剂来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2
(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol,又知H2O(l)=H2O(g)△H=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填写下列空格
(1)同温同压下,有0.3molO2与0.2molO3 , 它们的质量之比为 , 它们所含的原子数之比为 , 它们的体积之比为 , 它们的密度之比为 .
(2)由 ![]() H和
H和 ![]() O构成的水摩尔质量为 , 10g该水分子的物质的量为 , 含中子mol.
O构成的水摩尔质量为 , 10g该水分子的物质的量为 , 含中子mol.
(3)实验室需要0.1molL﹣1 NaOH溶液480mL.根据溶液的配制情况回答下列问题:根据计算用托盘天平称取NaOH的质量为g.在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度0.1molL﹣1(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度0.1molL﹣1 .
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物F是用于制备药品盐酸祛炎痛的中间产物,已知其合成路线如下:
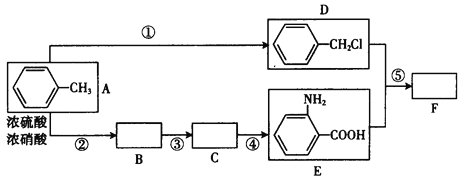
Ⅰ.RNH2+![]() CH2Cl
CH2Cl![]() RNHCH2
RNHCH2![]() +HCl(R和
+HCl(R和![]() 代表烃基)
代表烃基)
Ⅱ.苯的同系物易被高锰酸钾溶液氧化如下:
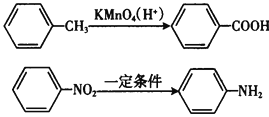
Ⅲ.苯胺具有弱碱性,易氧化。
回答下列问题:
(1)写出反应①的反应物质和条件_____________,B中所含官能团的名称_____________,C的结构简式__________________。
(2)D+E→F的化学方程式:______________。
(3)E的一种同分异构体(对位氨基)在一定条件下,可聚合成热固性很好的功能高分子,写出合成此高聚物的化学方程式__________________。
(4)写出D的含有苯环的同分异构体,已知该核磁共振氢谱图有3种不同类型的氢原子,峰面积之比为3 :2 :2,则该物质是______________(写结构简式)。
(5)反应①~⑤中,属于取代反应的是(填反应序号)________________,反应③的反应类型_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于卤代烃的叙述正确的是( )
A.所有卤代烃是难溶于水,比水重的液体
B.所有卤代烃在适当条件下都能发生消去反应
C.所有卤代烃都含有卤素原子
D.所有卤代烃都是通过取代反应制得的
查看答案和解析>>
科目: 来源: 题型:
【题目】“电解质的溶液中所有阳离子所带的正电荷数与所有阴离子所带的负电荷数相等,故显电中性,常称电荷守恒”.某盐的溶液中含有Na+、Mg2+、Cl﹣、SO ![]() 四种离子,若Na+为0.2mol,Mg2+为0.4mol,Cl﹣ 为0.4mol,则SO
四种离子,若Na+为0.2mol,Mg2+为0.4mol,Cl﹣ 为0.4mol,则SO ![]() 物质的量为( )
物质的量为( )
A.0.1mol
B.0.3mol
C.0.5mol
D.0.15mol
查看答案和解析>>
科目: 来源: 题型:
【题目】人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减。请回答:
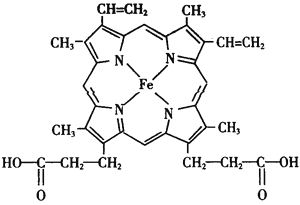
(1)铁原子L能层上有__________种不同运动状态的电子,基态铁原子的外围电子排布式为_____________。
(2)血红素是血液的重要组成部分,其结构如图。其中C原子和N原子具有的相同的杂化方式为________________,N与Fe之间存在的相互作用是___________。血红素在人
体内合成时的基本原料之一是甘氨酸(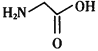 ),其分子中σ键和π键的个数比为___________。
),其分子中σ键和π键的个数比为___________。
(3)单质铁的某种晶体拥有体心立方晶胞,其配位数为___________,若其晶胞边长为a pm,其晶体密度为___________g/cm3(用含a的代数式表示,NA表示阿伏加德罗常数)。
(4)铁氰化钾(K3)俗称赤血盐,可用于检验Fe2+,反应的离子方程式为_____________。其配体的电子式为_______________,与其配体互为等电子体的微粒有_____________(任写两种,填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.将标准状况下11.2L HCl溶于水,配成250mL盐酸,溶液的物质的量浓度为2mol/L
B.硫酸和磷酸的摩尔质量相等
C.同温同压下,相同质量的二氧化碳和二氧化硫的体积比是16:11
D.2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com