
科目: 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体。某研究小组用下图所示的实验装置,利用浓氨水、干冰等作原料制备氨基甲酸铵。

(1)仪器a的名称是____________;与分液漏斗相比,使用滴液漏斗的优点是:______________________________________。
(2)装置B中盛装药品的名称是________________。
(3)写出装置D中发生反应的化学方程式:__________________________________。
(4)装置E的作用之一是控制原料气按反应计量系数充分反应。若反应初期观察到装置内浓硫酸中产生气泡,应该______(填“加快”、“减慢”或“不改变”)产生氨气的流速;装置E的作用还有___________________________________________________。
(5)已知氨基甲酸铵可完全水解为碳酸氢铵。为测定氨基甲酸铵样品的纯度,取样品1.600g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000g。
①写出碳酸氢铵与足量石灰水反应的离子方程式:______________________________。
②样品中氨基甲酸铵的质量分数为_____________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
查看答案和解析>>
科目: 来源: 题型:
【题目】节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油(即在汽油中添加一定量的甲醇),根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体(一氧化碳)排放量将近100万吨。常利用煤气化过程中生成的CO和H2来制备甲醇:CO+2H2![]() CH3OH。请根据图示回答下列问题:
CH3OH。请根据图示回答下列问题:

图1 图2
(1)关于该反应的下列说法中,正确的是____(填字母)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0
(2)现进行如下实验:在体积为1 L的密闭容器中,充入1 mol CO和3 mol H2,测得CO和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到反应达到平衡,CO的平均反应速率v(CO)=_____,该反应的平衡常数K=______。
(3)恒容条件下,达到平衡后,下列措施中能使n (CH3OH)/n(CO)增大的有______。
A.升高温度 B.充入气体He
C.再充入1 mol CO和3 mol H2 D.使用催化剂
(4)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍(此过程三种物质均处于气态),则平衡时混合气体的平均摩尔质量为_____________g/mol。
(5)根据图2,写出此反应的热化学方程式:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D之间的转化关系如图所示。下列说法正确的是( )
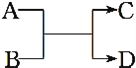
A. 若A为Fe,D为氢气,则B一定为酸
B. 若A、D为化合物,B为水,则C一定是气体单质
C. 若A、B、C、D均为化合物,该反应一定属于复分解反应
D. 若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应中伴随着能量变化.
(1)下列反应中,属于吸热反应的是(填序号).
a.燃烧CO b.Ba(OH)28H2O晶体和NH4Cl晶体反应
c.铝和稀盐酸反应 d.NaOH溶液和稀盐酸反应
(2)按如图1所示装置进行实验. 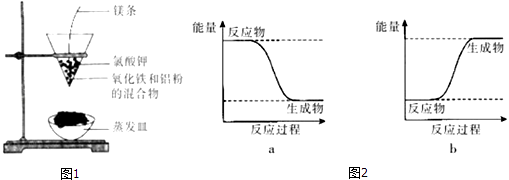
【实验现象】反应剧烈,火星四射,漏斗下方有红热熔融物流出.
由此判断该反应是(填“吸热”或“放热”)反应,其反应的化学方程式是 , 其能量变化可用图2中的(填“a”或“b”)表示.
查看答案和解析>>
科目: 来源: 题型:
【题目】证明海带中含有碘元素的实验方案如下,请你按要求补充完整:
步骤 | 实验过程 | 实验用品 |
I | 将干海带灼烧灰化 |
|
II | 将海带灰溶解、过滤 |
|
III | 氧化滤液中的I﹣ , 反应的离子方程式为② |
|
IV | 取少量III中反应后溶液于试管中,加入少量CCl4并振荡后静置,观察到③ , 说明海带中含有碘元素 |
|
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质在一定条件下反应产生等物质的量的气体时,消耗酸的物质的量最少的是
A. 碳与浓硫酸 B. 二氧化锰与浓盐酸
C. 铁与稀硫酸 D. 铜与稀硝酸
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250 mL溶液。
方案一:沉淀法。利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中w(Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是________(填编号)。
A.CaCl2溶液 B.MgSO4溶液 C.NaCl溶液 D.Ba(OH)2溶液
(2)过滤,提取沉淀,则过滤操作所需要的玻璃仪器除烧杯和玻璃棒外,还有_______。
(3)将沉淀洗涤,并充分干燥,称量沉淀的质量为mg,由此可以计算(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得w(Na2CO3)_______(填“偏大”、“偏小”或“无影响”)。
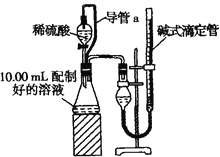
方案二:量气法。量取10.00 mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃、1.01×105 Pa)的体积,由此计算混合物中w(Na2CO3)。
(1)装置中导管a的作用是______________________________, 若撤去导管a会使测得气体体积_______(填“偏大”、“偏小”或“无影响”)。
(2)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:①___________________,②_________________________,③_______________________。
方案三:滴定法。量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L的盐酸滴定到终点(已知终点时反应H++ CO32-![]() HCO3-恰好完全,此时溶液pH<8)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。量取25.00 mL配制好的溶液,应选择碱式滴定管来完成。请问
HCO3-恰好完全,此时溶液pH<8)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。量取25.00 mL配制好的溶液,应选择碱式滴定管来完成。请问
(1)判断滴定终点的依据是_________________________。
(2)此法测得w(Na2CO3)=___________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com