
科目: 来源: 题型:
【题目】对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到:
![]() +H2SO4
+H2SO4![]()
![]() +H2O
+H2O
实验室可利用如图所示装置合成对氨基苯磺酸。实验步骤如下:

①在一个250 mL三颈烧瓶中加入10 mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18 mL浓硫酸。
②将三颈烧瓶置于油浴中缓慢加热至170~180 ℃,维持此温度2~2.5 h。
③将反应液冷却至约50 ℃后,倒入盛有100 mL冷水的烧杯中,玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干(100 mL水在20 ℃时可溶解对氨基苯磺酸1.08 g,在100 ℃时可溶解6.67 g)。
(1)装置中冷凝管的作用是____________________。
(2)步骤②中采用油浴加热,用油浴加热的优点是____________________。
(3)步骤③用少量冷水洗涤晶体的好处是____________________。
(4)步骤③和④均进行抽滤,在抽滤后停止抽滤时,应注意先__________________,然后__________________,以防倒吸。
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是____________________________。每次抽滤后均应将母液收集并适当处理,其目的是____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中离子一定能大量共存的是 ( )
A.0.1mol/LNaOH溶液中:Na+、K+、Ca2+ 、HCO3-
B.无色溶液中:H+、Fe2+、Al3+、NO3-
C.与铝产生氢气的溶液中:NH4+、Cl-、Mg2+、SO42-
D.pH>7的溶液中:Na+、K+、AlO2-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】氮和磷为周期表中的第VA族元素,它们的元素及其化合物在性质上既有相似性又有不同性。回答下列问题:
(1)N2分子中两个N原子都达到8电子稳定状态,则两个N原子之间共有电子的数目为____________;白磷的分子式为P4,4个P原子相互之间共形成6个共价单键,且每个P原子都达到8电子稳定状态,则白磷分子的空间构型为____________。
(2)N、P两种元素都能形成多种气态氢化物。联氨(N2H4)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离方程式___________________________,联氨与磷酸(H3PO4)形成的磷酸二氢盐的化学方程式为_________________________________。
(3)P2O5是一种干燥剂,下列气体不能用P2O5干燥的是________(填字母序号)。
A.SO2 B.NH3 C.CO D.H2 E.H2S F.O2
(4)次磷酸(H3PO2)是一元中强酸,它的工业制法是将白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式________,Ba(H2PO2)2为_______________(填“正盐”或“酸式盐”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤燃烧产生的粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是火电厂产生的废渣,若不加处理会污染环境。为综合利用,研究人员对其进行如下处理:
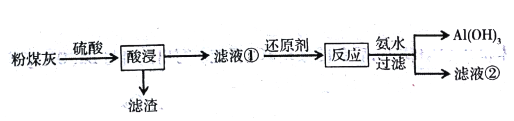
(1)滤渣主要成分是________________;滤液①中的阳离子为_____________________。
(2)滤液①中还加入还原剂原因是________________;若加入的还原剂为铁粉,反应的离子方程式为_____________________________________。
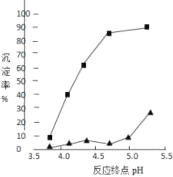
(3)加入氨水是为了调节pH使铝离子沉淀,其离子方程式为_________________;反应终点的pH对铝和铁分离效果的影响如右图。根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是__________,选择该范围的理由是_________。
(4)NH4HSO4和H2SO4按物质的量比1:1混合溶于水配制成浸取液,220℃时可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4) 2],然后分离、煅烧获得纯Al2O3。
查阅资料知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g 。②280℃时分解。
①依据资料可知,将硫酸铝铵与其他溶质分离的方法是_____________。
②煅烧NH4Al(SO4)2时发生4NH4Al(SO4)2![]() 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,得到混合气体(NH3、N2、SO2、SO3、H2O)。若16mol混合气体按如下装置被完全吸收制得浸取液。则右下图中,试剂X是___________(填化学式);试剂Y是_________(填名称),其中溶质的物质的量为_____________。
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,得到混合气体(NH3、N2、SO2、SO3、H2O)。若16mol混合气体按如下装置被完全吸收制得浸取液。则右下图中,试剂X是___________(填化学式);试剂Y是_________(填名称),其中溶质的物质的量为_____________。

查看答案和解析>>
科目: 来源: 题型:
【题目】三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医疗上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,缓解刺激。将0.184g三硅酸镁(Mg2Si3O8·nH2O)加入到50 mL0.1 mo1·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mo1· L-1 NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30mL,则n为
A. 6 B. 5 C. 4 D. 3
查看答案和解析>>
科目: 来源: 题型:
【题目】新型净水剂高铁酸钠(Na2FeO4)可通过以下反应制备:Fe2O3+3Na2O2 ![]() 2Na2FeO4+Na2O,下列说法正确的是( )
2Na2FeO4+Na2O,下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.在Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒
D.3 mol Na2O2发生反应,有12 mol电子转移
查看答案和解析>>
科目: 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( ) 
A.Mg2+、Al3+、Fe2+
B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+
D.只有Mg2+、Al3+
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E均是由下列离子组成的可溶性化合物.组成这五种物质的离子有(离子不能重复组合):
阳离子 | Na+、Mg2+、Al3+、Ba2+、Fe3+ |
阴离子 | OH﹣、Cl﹣、CO |
分别取它们进行实验,结果如下:
①A溶液与D溶液混合,没有明显现象;
②当B溶液加入到D溶液中时,有沉淀产生.继续加入B溶液,沉淀全部消失.
③将E溶液加热,有沉淀生成.
据此推断:A ;B ;C ;D ;E .
查看答案和解析>>
科目: 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如下图所示.试回答: 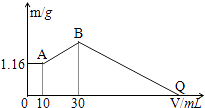
(1)A点的沉淀物的化学式为 , B点的沉淀物的化学式为 .
(2)原混合物中MgCl2的质量是g,AlCl3的质量是g,NaOH的质量是g.
(3)Q点HCl溶液加入量是mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com