
科目: 来源: 题型:
【题目】甲烷作为一种新能源应用广泛,请回答下列问题:
(1)竖炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g) =2CO(g)+2H2(g) △H=260kJ·mol-1
2CO(g)+O2(g) = 2CO2(g) △H= -566kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为____________________
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液)通过装置Ⅱ实现铁棒上镀铜
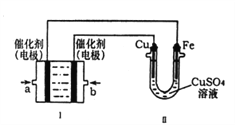
①a处应通入_________(填CH4或O2),b处电极上发生的电极反应式是______;
②电镀结束后,装置Ⅰ中溶液的pH______。(填写变大、变小或不变,下同),装置Ⅱ中Cu2+的物质的量是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.28g氮气所含有的原子数目为NA
B.在常温常压下,11.2L N2含有的分子数为0.5NA
C.0.5mol单质铝与足量盐酸反应转移电子数为1.5NA
D.标准状况下,1L水所含分子数为1/22.4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图)。其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
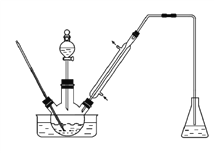
下列说法错误的是
A. 甲同学认为步骤1中使用1,2-二氯乙烷的目的是做催化剂,加快反应速率
B. 乙同学认为可在该实验装置的冷凝管后加接一只装有无水MgSO4的干燥管,实验效果可能会更好
C. 丙同学认为步骤2中有机相使用10%NaHCO3溶液洗涤可除去大部分未反应完的Br2
D. 丁同学认为步骤4中减压蒸馏有机相是因为间溴苯甲醛高温下容易氧化或分解
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
A.2Na+2H2O=2NaOH+H2↑
B.CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
C.2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
D.CaCO3+2HCl=CaCl2+H2O+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学原理在工业生产、生活中有重要的作用
(1)图甲是工业上用惰性电极电解饱和食盐水的原理示意图,a电极为_______极,电极反应式为________,溶液B为_______溶液,电解总反应的离子方程式为_____________.标况下生成33.6Cl2,通过离子交换膜的Na+物质的量为__________.


(2)通过NO传感器可检测NO的质量,其工作原理示意图如图乙。Pt电极上发生的是_________反应(填“氧化”或“还原”);写出NiO电极的电极反应式是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸毗醛素是细胞的重要组成部分,其结构式如下,下列有关叙述不正确的是
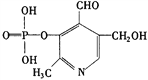
A. 该物质是一种磷酸酯类化合物
B. 该有机物能发生银镜反应
C. 该有机物可以发生取代、加成、氧化、还原、聚合反应
D. 1mol该有机物与NaOH溶液反应,最多消耗5mol NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2O是_____色固体,与水反应的化学方程式为___________。Na2O2是_____色固体,与水反应的化学方程式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】正确表示下列反应的离子方程式的是( )
A. 氢氧化钠溶液与盐酸反应:H++OH-=H2O B. 铁溶于氯化铁溶液:Fe3++Fe=2Fe2+
C. 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】含氮化合物在工农业生产中有重要作用。
(1)氨和N2H4是两种常见的氮氢化合物。已知:
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)△H1=-541.8kJ·mol-1
2N2(g)+6H2O(g)△H1=-541.8kJ·mol-1
N2H4(g)+O2(g)![]() N2(g)+2H2O(g)△H2=-534kJ·mol-1
N2(g)+2H2O(g)△H2=-534kJ·mol-1
则NH3(g)和O2(g)制取N2H4(g)的热化学方程式为_______________
(2)二氧化氮在一定条件下能发生如下反应:
NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=-42kJ·mol-1
SO3(g)+NO(g) △H=-42kJ·mol-1
在体积为2L的恒容密闭容器中充入SO2(g)和NO2(g),实验所得数据如下:
实验编号 | 温度 | 起始物质的量/mol | 平衡时物质的量/mol | |
n(SO2) | n(NO2) | n(NO) | ||
甲 | T1 | 4 | 2 | 0.8 |
乙 | T2 | 2 | 4 | 0.6 |
丙 | T1 | 2 | 1 | a |
①在实验甲中,若2min时测得放出的热量是8.4kJ,该温度下的平衡常数为_______(保留到小数点后两位)
②由表中数据可推知T1_____T2(填“﹥“<”或“=”)
③实验丙中,达到平衡时NO2的转化率为_______
(3)使用间接电化学法可以处理煤烟气中的NO,反应原理如下图所示,已知电解池溶液的pH在4-7之间,写出阴极的电极反应式____________________。
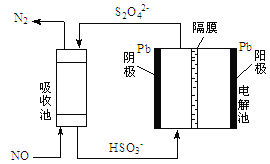
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com