
科目: 来源: 题型:
【题目】关于非金属元素Si、N、S、Cl的叙述,正确的是
A. 通常情况下,它们的单质均为气体 B. 它们在自然界中都存在游离态的单质
C. 它们都有对应的含氧酸 D. 每种元素都只有一种氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气在氯气中燃烧产生苍白色火焰,在反应中破坏1 mol氢气中的化学键吸收的能量为a kJ,破坏1 mol 氯气中的化学键吸收的能量为b kJ,形成1 mol氯化氢中的化学键释放的能量为c kJ。下列关系式中正确的是
A. a+b=2c B. a+b>2c C. a+b<c D. a+b<2c
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. SO2、Cl2均能使品红溶液永久性褪色
B. NH4HCO3晶体、固体碘受热均能变成气体都是因为升华
C. 铁分别与氯气、硫反应都生成含三价铁的化合物
D. OH-与Mg2+、Cu2+均因为生成难溶物而不能在溶液中大量共存
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年国产C919大型客机正式下线,标志着我国成为世界上少数几个具有自行研制大型飞机的国家之一,标志着我国航空工业进入了新的发展阶段.
I. 飞机的外壳通常采用钛铝合金材料。
(1)基态Ti原子的价电子轨道表示式为__________。
(2)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为_______________________________ (标明配位键)。
(3)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为__________________________________。
II. 现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料--玻璃纤维增强塑料,其成分之一为环氧树脂。
(4)常见的E51型环氧树脂中部分结构如下图所示:
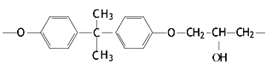
其中碳原子的杂化方式为________,它们的个数比为______。
III. 大型飞机的发动机被誉为航空工业皇冠上的“宝石”。制造过程中通常采用碳化钨做关键部位的材料
(5)钨元素位于周期表的第六周期第VIB族,已知该元素价电子不遵循半充满排布规律,请写出其外围电子排布式___________。
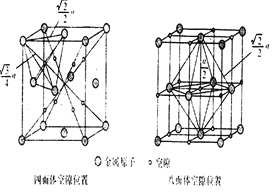
(6)下图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有______个,1个钨原子周围距离钨原子最近的碳原子有____个,C原子填入钨原子组成的_____空隙。钨原子填入碳原子组成的_________空隙。下列金属元素的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是______
A.FeCuB.TiAu C.MgZnD.CuAg
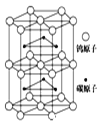
(7)假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为Mg/mol,密度为bg/cm3,则阿伏加德罗常数NA用上述数据可以表示为___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】将14g铜银合金与足量的HNO3反应,将产生的气体与1.12L O2(标准状况下)混合后,通入水中,恰好被全部吸收,则合金中Ag的质量为( )
A.3.2 g
B.4.8 g
C.6.4 g
D.10.8 g
查看答案和解析>>
科目: 来源: 题型:
【题目】对金属制品进行抗腐蚀处理,可减缓金属的腐蚀,延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
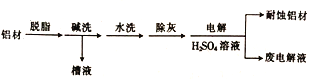
①碱洗的目的是除去铝表面的自然氧化膜(Al2O3),有关反应的离子方程式为_________________。碱洗时常有气泡冒出,该气体是_________ (填化学式)。
②电解时,处理好的铝材应与电源的________极相连,铝材表面形成氧化膜的电极反应式为_______。
(2)钢铁容易生锈的主要原因是钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在酸性环境下,其正极反应式为_________;在酸性很弱或中性条件下,其发生_______(填“析氢腐蚀”或“吸氧腐蚀”)。
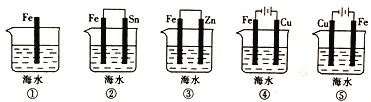
(3)下列装置中铁片腐蚀由快到慢的顺序是____________(用序号表示)。
(4)利用如图装置,可以模拟铁的电化学防护。
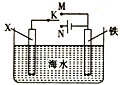
若X为碳棒,开关K置于N处,该电化学防护法称为______;若X为锌棒,开关K置于M处,_____(填“能”或“不能”)达到防止铁腐蚀的目的。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组同学设计如下装置(图中药品均足量):
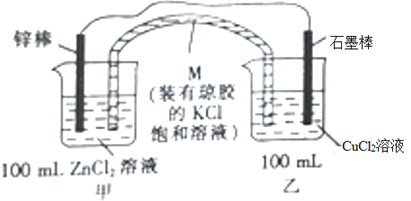
(1)M的名称是_________。
(2)烧杯乙中的现象是_____________________________。
(3)负极的电极反应式为____________________________________________,电池总反应的化学方程式为_____________。
(4)M的作用是向甲、乙两绕杯中提供K+或Cl-,以确保溶液呈电中性。当锌棒质量变化6.5g时,从M中进入装置乙内的离子是__________,其浓度为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:

下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com