
科目: 来源: 题型:
【题目】某温度时,反应C(s)+H2O(g)![]() CO(g)+H2(g)在密闭容器中进行,下列条件的改变对其反应
CO(g)+H2(g)在密闭容器中进行,下列条件的改变对其反应
速率几乎无影响的是
A. 增加CO的量
B. 将容器的体积缩小一半
C. 保持体积不变,充入N2使体系压强增大
D. 保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为6mol,用D表示的化学反应速率v(D)为0.4mol/(Lmin).请回答下列有关问题:
(1)5min末A的物质的量浓度为 .
(2)前5min内用B表示的化学反应速率v(B)为 .
(3)化学方程式中n值为 .
(4)此反应在四种不同情况下的反应速率分别为: ①v(A )=5mol/( Lmin ) ②v( B )=6mol/( Lmin )
③v(C)=4.5mol/( Lmin ) ④v(D )=8mol/( Lmin )
其中反应速率最快的是(填编号).
查看答案和解析>>
科目: 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式如图。有关柠橡烯的分析正确的是
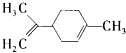
A. 柠檬烯的分子式为C10H14
B. 柠檬烯和丁基苯(![]() )互为同分异构体
)互为同分异构体
C. 柠檬烯的分子中所有的碳原子可能在同一个平面上
D. —定条件下,柠檬烯可以发生加成、取代、氧化等反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是 ( )
A.使用催化剂不能改变化学反应的反应热
B.蛋白质溶液具有丁达尔效应,说明该蛋白质分子直径约1nm~100nm
C.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
D.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体均为氢氧化钠
查看答案和解析>>
科目: 来源: 题型:
【题目】现有反应:mA (g) +nB (g)![]() pc (g) ,达到平衡后,当升高溫度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pc (g) ,达到平衡后,当升高溫度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为____热反应,且m+n____p (填“>”、 “=” 、“<”)。
(2)减压时,A的质量分数______.(填“增大”、“减小”或“不变”,下同)
(3)若加入B (体积不变),则A的转化率_____,B的转化率_________。
(4)若升高溫度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量______________。
(6)若B是有色物质,A、C均无色,则加入C (体积不变)时混合物颜色______,而维持容器内压强不变,充入氖气时,混合物颜色______(填“变深”、 “变浅”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D、E、F的原子序数逐渐增大,A和B同周期,A和F同族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的简单阴离子与C、D、E的简单阳离子电子层结构相同.请回答下列有关问题:
(1)F在元素周期表中的位置是 .
(2)C2B2的电子式是;AB2的结构式是 .
(3)B、C、D、E离子半径由大到小的顺序为(用离子符号回答); C、D、E最高价氧化物对应水化物的碱性由强到弱的顺序为(用化学式表示,且用“>”符号连接回答).
(4)C、E最高价氧化物对应水化物能够相互反应,则反应的离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】在H2SO4和Al2(SO4)3的混合溶液中,铝离子浓度是0.4 mol / L,硫酸根离子浓度是0.7 mol / L,则氢离子浓度约是 ( )
A.0.1 mol / LB.0.2 mol / LC.0.3 mol / LD.0.4 mol / L
查看答案和解析>>
科目: 来源: 题型:
【题目】取一定质量的Cu2O和CuO混合粉末,将其均匀混合后分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
A.3.6mol/L
B.3.2mol/L
C.2.8mol/L
D.2.4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:2NO2 ![]() 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是:①单位时间内生成n molO2的同时生成2n molNO2②用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态③混合气体的颜 色不再改变的状态④混合气体的密度不再改变的状态⑤混合气体的平均摩尔质量不再改变的状态 ⑥混合气体的压强不再改变的状态( )
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是:①单位时间内生成n molO2的同时生成2n molNO2②用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态③混合气体的颜 色不再改变的状态④混合气体的密度不再改变的状态⑤混合气体的平均摩尔质量不再改变的状态 ⑥混合气体的压强不再改变的状态( )
A.①②③④
B.③④⑤⑥
C.①③⑤⑥
D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)①常温下,.某溶液中由水电离出的c(OH-)=1.0×10-10mol/L,该溶液可以是_________。(填选项)
A. pH=4的CH3COOH B.pH=10的NaOH C. pH=9的 Na2CO3
D. pH=2的 H2SO4 E. pH=4的 NH4C1
(2)常温下,aml/0.lmol/L盐酸与bmL0.lmol/L氨水混合,充分反应,若混合后溶液呈中性,则a____b (填“<”、“>”或“=”)。
(3)常温下,amLpH=3的盐酸与bmLpH=11的氨水混合,充分反应,若a=b,,则反应后溶液中离子浓度从大到小的顺序是___________。
(4)氯化铝水溶液呈酸性,原因是(用离子方程式表示〉:___________。把A1Cl3溶液蒸干,灼烧,最后得到的主要固体产物是___________。
(5)25℃,在0.10 mol/LH2S溶液中,通入HC1气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下图(忽略溶液体积的变化、H2S的挥发)。
① pH=13时,溶液中的 c(H2S)+c(HS-)=_________mol/L。
② 某溶液含 0.020 mol /LMn2+、0.10 mol/LH2S,当溶液pH=_____时,Mn2+开始沉淀。(Ksp(MnS) =2.8×1013)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com