
科目: 来源: 题型:
【题目】将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+ . 将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中单质铁的质量是( )
A.2.24g
B.3.36g
C.5.60g
D.10.08g
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A. X的原子半径一定大于Y的原子半径
B. X与Y的简单离子不可能具有相同的电子层结构
C. 两元素形成的化合物中,原子个数比不可能为1 :1
D. X2Y可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. 油脂能在碱性条件下水解,可用于工业上制取肥皂
B. 碘单质易溶于有机溶剂,可用酒精萃取碘水中的碘
C. 二氧化锰具有较强的氧化性,可用于H2O2分解的氧化剂
D. 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所给信息填空
(1)用0.1mol/L的酸性高锰酸钾溶液测定FeSO4溶液的浓度时,因FeSO4溶液放置时间较长,导致测定结果(填“偏大”、“不变”或“偏小”)
(2)过氧化钠的电子式
(3)选出下列说法中正确的
①氧化物都能与酸或碱的溶液反应
②红宝石、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐
③由相同元素组成的物质一定是纯净物
④浓氨水滴加到FeCl3溶液中可制取Fe(OH)3胶体
⑤向容量瓶中转移液体时,玻璃棒不可以接触到容量瓶的瓶口
⑥用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
⑦金属Mg的活泼性比Al强,由Al2O3能与NaOH溶液反应推知MgO也能与NaOH溶液反应
⑧SiO2既能和NaOH溶液反应也能和氢氟酸反应,所以是两性氧化物
⑨3mol单质Fe在氧气中完全转变为Fe3O4 , 失去8NA个电子
⑩用含硅胶、铁粉的透气小袋与食品一起密封包装,利用了Fe粉的还原性
(4)浓硝酸久置变黄
(5)明矾溶液与少量氢氧化钡溶液反应的离子方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于元素周期表和元素性质的叙述正确的是
A.质子数相同的微粒之间一定互称同位素
B.I A族与ⅦA族元素间形成的化合物一定是离子化合物
C.同主族元素的简单阴离子半径越大,其单质氧化性越弱
D.同周期金属元素的化合价越高,其氢氧化物的碱性越强
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种.下列根据实验事实得出的结论错误的是( )
A.取一定量固体,溶解,向溶液中通入足量的CO2 , 观察到有晶体析出,说明原固体中一定含有 Na2CO3
B.取一定量固体,溶解,向溶液中加人适量CaO粉末,充分反应后观察到有白色沉淀生成,说明 原固体中一定含有Na2CO3
C.取一定量固体,溶解,向溶液中滴加适量AgNO3溶液后有白色沉淀生成,这个现象不能说明原固体中一定含有NaCl
D.称取3.80g固体,加热至恒重,质量减少了 0.620g.用足童稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化能一步实现的是( )
A.Na ![]() Na2O2
Na2O2 ![]() Na2CO3
Na2CO3
B.MgCO3 ![]() MgCl2溶液
MgCl2溶液 ![]() Mg
Mg
C.Al2O3 ![]() Al(OH)3
Al(OH)3 ![]() AlCl3
AlCl3
D.S ![]() SO3
SO3 ![]() H2SO4
H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________________。
(2)该反应为____________反应(选填吸热、放热),原因是_____________________。
(3)能判断该反应是否达到化学平衡状态的依据是________________(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _______________℃。该温度下,若向容器中分别加入2mol H2和2molCO2,10s后达到平衡,则这段时间内υ(H2)=_______________, CO2的转化率为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向含Fe2+、I﹣、Br﹣的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b﹣a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )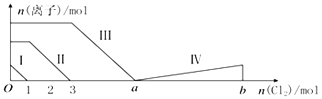
A.线段Ⅱ表示Br﹣的变化情况
B.线段Ⅳ表示IO3﹣的变化情况,其中IO3﹣增加了5moL.
C.a=6
D.原溶液中n(FeI2):n(FeBr2)=3:1
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,可由下列反应制得:2Fe(OH)3+3Cl2+10KO ![]() 2K2FeO4+6KCl+8H2O下列关于该反应说法正确的是( )
2K2FeO4+6KCl+8H2O下列关于该反应说法正确的是( )
A.KOH是氧化剂
B.Cl2发生还原反应
C.KFeO4是氧化产物
D.生成1mol K2FeO4转移6mol的电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com