
科目: 来源: 题型:
【题目】A、B、C、D四种元素.原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和.
(1)A为元素,B为元素;C为元素.D的质子数和中子数相等,D的原子组成符号为 , 它的最高价为价.
(2)用电子式表示A、D两元素形成AD2的过程: , 用电子式表示C、D两元素形成化学键的过程: .
(3)写出E和A的最高价氧化物反应的化学方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】PbO2及2PbCO3Pb(OH)2(碱式碳酸铅)均是生产铅酸蓄电池正极的原料.
(1)PbO2可由NaClO氧化Pb(NO3)2溶液得到.
①Pb(NO3)2被氧化为PbO2的离子方程式为 .
②Pb(NO3)2溶液中通入H2S发生Pb2+(aq)+H2S(aq)PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K=1已知:Ksp(PbS)=3.55×10﹣28;H2S电离常数Ka1=1.3×10﹣7 , Ka2=7.1×10﹣15].
(2)制备碱式碳酸铅的实验步骤如图1: 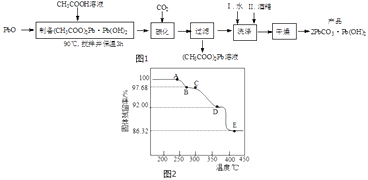
①“碳化”时,发生反应的化学方程式为 .
②“洗涤”时,经水洗涤后再用酒精洗涤的目的是 .
(3)为确定2PbCO3Pb(OH)2(相对式量:775)的热分解过程,进行如下实验:称取一定量(2)实验制得的样品放在热重分析仪中,在氩气流中热分解,测得样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图2所示.
①A→B过程中,从体系中逸出的分解产物(化合物)为(填化学式);C→D过程中,从体系中逸出的分解产物(化合物)为(填化学式).
②根据图中实验数据,计算并确定E点残留固体的化学式(写出计算过程).
查看答案和解析>>
科目: 来源: 题型:
【题目】盐酸赛庚啶是一类抗凝血、抗过敏类新药,其关键中间体H的合成路线如图: 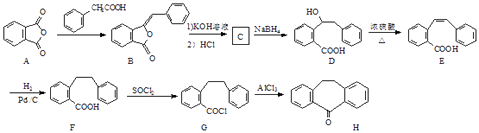
(1)D中含氧官能团名称为和 .
(2)D→E的反应类型为 .
(3)C还原可得到D,C的分子式为C15H12O3 , 写出C的结构简式
(4)写出同时满足下列条件的E的一种同分异构体的结构简式
①含有两个苯环且能发生银镜反应②分子中只有4种不同化学环境的氢
(5)请以 ![]() 为原料制备
为原料制备 ![]() ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
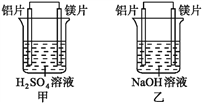
请回答:
(1)写出甲池中正极的电极反应式:________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极_____________,总反应的离子方程式为________________。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出___活动性更强,而乙会判断出___活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?___(填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
查看答案和解析>>
科目: 来源: 题型:
【题目】下列生产、生活、实验中的行为,符合安全要求的是 ( )
A. 进入煤矿井下作业,戴上安全帽,用帽上的矿灯照明
B. 节日期间,可以在热闹繁华的商场里燃放烟花爆竹,欢庆节日
C. 点燃打火机,可以检验液化气钢瓶口是否漏气
D. 实验室里,可以将水倒入浓硫酸中及时用玻璃棒搅拌,配制稀硫酸
查看答案和解析>>
科目: 来源: 题型:
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

(1)该反应为____________(填“放热”或“吸热”)反应。
(2)A和B的总能量比C和D的总能量____________(填“高”或“低”)。
(3)物质中的化学能通过________转化成________释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘化钡(BaI22H2O)是一种白色粉末,常用于制取其他含碘化合物.一种制备流程如图1: 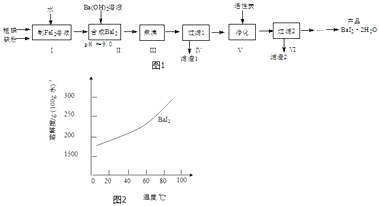
(1)步骤Ⅰ制FeI2溶液时,提高反应速率的可行措施有(填序号).
a.铁粉和碘粉用球磨机磨成细粉
b.增大n(铁粉):n(碘)的配料比
c.适当升高反应温度和搅拌速度
d.向反应器中加水至I2全部溶解
(2)步骤Ⅱ发生反应的化学方程式为;用pH试纸测定溶液pH的方法是
(3)步骤Ⅲ小心“煮沸”约20分钟,可使Fe(OH)2颗粒长大,其目的是;步骤V加入活性炭的目的是 .
(4)从过滤2所得滤液中获得BaI22H2O(溶解度曲线如图2所示)的方法是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t/°C | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是(____)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_______℃。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列生活、生产中的问题不能用平衡移动原理解释的是
A. 实验室可以用排饱和食盐水的方法收集氯气
B. 将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
C. 高压有利于工业上合成氨
D. 打开汽水瓶时,瓶中立即泛起大量泡沫
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com