
科目: 来源: 题型:
【题目】下列与有机物结构、性质相关的叙述不正确的是( )
A.苯分子中所有原子均在同一平面
B.乙烷中混有少量的乙烯可通过酸性高锰酸钾溶液进行除杂
C.甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于SiO2的说法,正确的是( )
A. SiO2是制造光导纤维的重要材料
B. SiO2溶于水生成硅酸
C. SiO2对应水化物的酸性比碳酸强
D. SiO2是两性氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应方程式中的水作还原剂的是( )
A.NaH+H2O=NaOH+H2↑
B.Cu2O+H2SO4=Cu+CuSO4+H2O
C.2F2+2H2O=4HF+O2
D.SO2+Cl2+2H2O=H2SO4+2HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH ![]() 、Mg2+、Al3+、SO
、Mg2+、Al3+、SO ![]() 、NO3﹣、Cl﹣ . 某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:
、NO3﹣、Cl﹣ . 某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验: 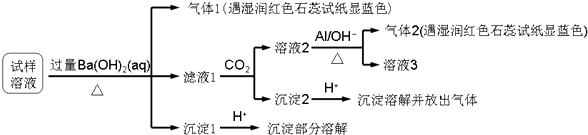
已知:3NO ![]() +8Al+5OH﹣+2H2O
+8Al+5OH﹣+2H2O ![]() 3NH3↑+8AlO
3NH3↑+8AlO ![]()
根据以上的实验操作和现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH4+、Mg2+、SO42﹣和NO3﹣
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl﹣
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: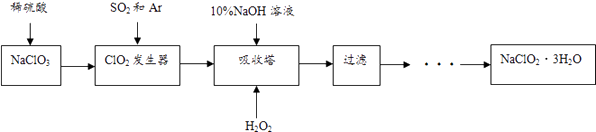
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O
②纯ClO2常温下为气体,易分解爆炸,一般用稀有气体或空气稀释到10%以下安全
(1)10%的NaOH溶液的密度为1.2g/cm3其物质的量浓度为 .
(2)在ClO2发生器中当1gSO2完全转化时,放出akJ热量,写出该热化学反应方程式鼓入Ar的作用是 .
(3)写出吸收塔内发生的化学反应方程式 . 吸收塔的温度不能超过40℃,其目的是 .
(4)从滤液中得到的NaClO23H2O粗晶体中往往含有杂质,要得到更纯的NaClO23H2O晶体方法是 .
(5)工业处理含NaClO2废水时,先向废水中加入适量NaOH,用惰性电极电解该废水,同时制得NaClO3 , 写出ClO2﹣在阳极放电时的电极反应方程式 .
(6)已知SO2和Ar的混合气体中,SO2的百分含量为5.6a%,当bL(标况下)该混合气体参加反应时,理论上需要的17%的H2O2的质量为g(结果必须化简).
查看答案和解析>>
科目: 来源: 题型:
【题目】已知聚酯F是分子主链上带有苯环和酯基的特种工程塑料结构为 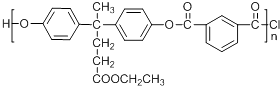 在航空航天等领域具有广泛应用.下图是利用乙酰丙酸CH3COCH2CH2COOH,合成聚酯F的路线如下:
在航空航天等领域具有广泛应用.下图是利用乙酰丙酸CH3COCH2CH2COOH,合成聚酯F的路线如下: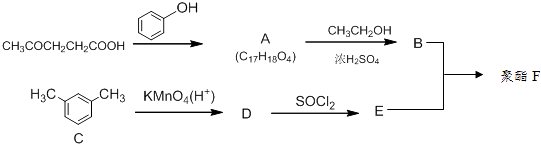
已知:① ![]() ②
② ![]() (R、R′表示烃基)
(R、R′表示烃基)
(1)乙酰丙酸中含有的官能团是羰基和(填官能团名称)
(2)C的系统命名为
(3)B、E合成聚酯F的反应类型为写出D生成E的化学反应方程式
(4)乙酰丙酸生成A的化学反应方程式为
(5)下列关于有机物B的说法正确的是(填字母代号).a.1mol该物质最多能与2molNaOH反应b.1mol该物质最多能与2molBr2发生取代反应
c.不能发生消去反应d.能与H2发生加成反应
(6)C8H6O4符合下列条件的D的同分异构体有种.①能发生银镜反应 ②能与NaHCO3溶液反应 ③分子中有苯环,分子中无 ![]() 结构.
结构.
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾(FeSO47H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究: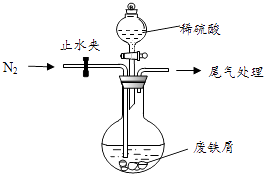
(1)【制备产品】
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用如图所示装置制备FeSO47H2O晶体,步骤如下:
①预处理:先将废铁屑加入到饱和Na2CO3溶液中洗涤,目的是 , 然后将废铁屑用水洗涤2~3遍.
②将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入N2 , N2的作用是 .
③再加入足量稀硫酸,控制温度50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为 .
④获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤, , . 滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干,密闭保存.
(2)【测定FeSO47H2O含量】
①称取上述样品10.0g,溶于适量的稀硫酸中,配成100mL溶液,需要的仪器除天平、胶头滴管、烧杯、量筒外,还需要的仪器有(填仪器名称)、 . 胶头滴管,250ml容量瓶…
②准确量取25mL该液体于锥形瓶中,用0.1000mol/L KMnO4标准溶液滴定,则滴定终点的判断方法是 .
③用同样的方法滴定3次,平均消耗10.00mL标准液,该样品中FeSO47H2O的质量分数为 . (已知Mr(FeSO47H2O)=278)
④若测量结果偏小,则可能是在定容时(填“俯视”或“仰视”)读数.
查看答案和解析>>
科目: 来源: 题型:
【题目】试根据碱金属元素性质的递变规律推测下列说法,其中不正确的是( )
A. 碳酸铯比碳酸氢铯稳定
B. 氢氧化铯是一种强碱
C. 可能存在过氧化铯
D. 铯在金属活动性顺序表中排在钾后面
查看答案和解析>>
科目: 来源: 题型:
【题目】表为元素周期表的一部分,请参照元素①⑧在表中的位置,回答下列问题: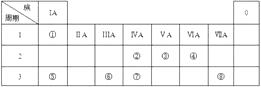
(1)①、③、④三种元素形成的既含离子键又含共价键的化合物的化学式为 , 与③同主族的短周期元素的最高价氧化物的水化物为 , ⑧的最高价氧化物的水化物的化学式为 .
(2)③、④、⑤、⑥形成的简单离子半径由大到小的顺序是(用离子符号表示);
(3)写出⑤的最高价氧化物对应的水化物与⑥的最高价氧化物反应的离子方程式:;
(4)在②与 ⑦中,化学性质较活泼的是(写元素符号),写出可以验证该结论的一个离子反应方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识,完成下面题目:
(1)写出表示含有8个质子,10个中子的原子的化学符号: .
(2)根据下列微粒回答问题: ![]() H、
H、 ![]() H、
H、 ![]() H、14C、14N、16O、35Cl2、37Cl2 . ①以上8种微粒共有种核素,共种元素.
H、14C、14N、16O、35Cl2、37Cl2 . ①以上8种微粒共有种核素,共种元素.
②互为同位素的是 .
③质量数相等的是和 , 中子数相等的是和 .
(3)相同物质的量的14CO2与S18O2的质量之比为;中子数之比为;电子数之比为 .
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是: . (铷的相对原子量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com