
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A.光导纤维、醋酸纤维、玻璃纤维、纤维素等的主要成分都是糖类
B.淀粉、纤维素的分子式都是(C6H10O5)n , 二者互为同分异构体
C.乙醛、葡萄糖与新制的Cu(OH)2悬浊液共热,都产生砖红色沉淀
D.纤维素和淀粉遇碘水均显蓝色
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO47H2O),其过程如图1所示: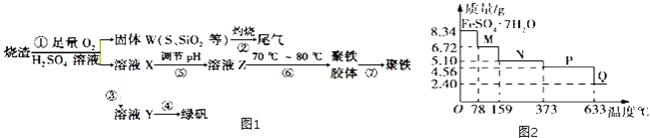
(1)画出铁的原子结构示意图 ,
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为 .
(3)过程③中,需要加入的物质名称是 . 过程④的实验操作 .
(4)过程⑥中,将溶液Z加热到70℃~80℃,目的是 .
(5)8.34g FeSO47H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图2所示.下列说法中正确的是
A.温度为78℃时固体物质M的化学式为FeSO45H2O
B.温度为159℃时固体物质N的化学式为FeSO43H2O
C.在隔绝空气条件下由N得到P的化学方程式为FeSO4 ![]() FeO+SO3↑
FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验.①用分析天平称取样品2.700g;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495g.若该聚铁主要成分为[Fe(OH)SO4]n , 则该聚铁中铁元素的质量分数为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.苯酚钠溶液中通入少量CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣
B.甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH﹣ ![]() HCOO﹣+NH4++2Ag↓+3NH3+H2O
HCOO﹣+NH4++2Ag↓+3NH3+H2O
C.向小苏打溶液中加入醋酸:CO32﹣+2CH3COOH═CO2↑+H2O+2CH3COO﹣
D.乙醛与碱性氢氧化铜悬浊液混合后加热至沸腾:CH3CHO+2Cu(OH)2+OH﹣ ![]() Cu2O↓+CH3COO﹣+3H2O
Cu2O↓+CH3COO﹣+3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】将1.52g铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法正确的是( )
A. 该合金中铜与镁的物质的量之比是1:2
B. 该浓硝酸中HNO3的物质的量浓度是7.0 mol/L
C. NO2和N2O4的混合气体中,N2O4的体积分数是20%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题: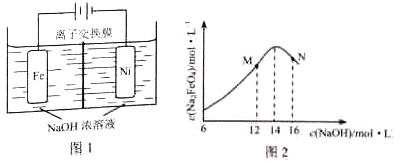
(1)与汽油相比,氢气作为燃料的优点是(至少答出两点).但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式: .
(2)氢气可用于制备H2O2 . 已知:
H2(g)+A(l)═B(l)△H1
O2(g)+B(l)═A(l)+H2O2(l)△H2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)═H2O2(l)的△H=0(填“>”或“=”)
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)MHx+2y(s)△H<0达到化学平衡.下列有关叙述正确的是
a.容器内气体压强保持不变
b.吸收ymol H2只需1molMHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为 .
(5)化工生产的副产氢也是氢气的来源,电解法制取有广泛用途的Na2FeO4 . 同时获得氢气:Fe+2H2O+2OH﹣→FeO42﹣+3H2↑,装置如图所示,装置通电后,铁电极附近生成紫红色FeO42﹣ , 镍电极有气泡产生.若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质.
已知:Na2FeO4只在强碱性条件下稳定,易被H2还原.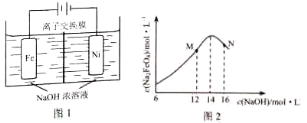
①电解一段时间后,c(OH﹣)降低的区域在(填“阴极室”或“阳极室”).
②电解过程中,须将阴极产生的气体及时排出,其原因为 .
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因 .
查看答案和解析>>
科目: 来源: 题型:
【题目】CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下:
![]()
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌被O2氧化生成FeOOH晶种。生成晶种的化学方程式为_________;
(2)步骤③将FeOOH固体在200~300℃下加热脱水,生成红色Fe2O3。实验室完成该操作需要下列仪器中的________(填字母)。
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(3)步骤④通入H2,加热至300~400℃,生成Fe3O4。通入H2前要向加热炉中通入N2,其作用为_____。
(4)CoC2O4是制备钴的氧化物的重要原料;取18.3g CoC2O4·2H2O在空气中加热至350℃充分反应,生成钴氧化物8.03克。通过计算确定此钴氧化物的化学成分为___(填化学式)。
(5)另取一定量二水合草酸钴在某温度下分解产生的钴氧化物(其中所含Co的化合价为+2、+3)与560 mL 5 mol·L-1盐酸充分反应,钴氧化物恰好完全溶解,得到CoCl2溶液和标准状况下的黄绿色气体4.48 L。试确定该钴氧化物中Co、O的物质的量之比____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
①NaHCO3溶液加水稀释, ![]() 的比值保持增大
的比值保持增大
②浓度均为0.1molL﹣1的Na2CO3、NaHCO3混合溶液:2c(Na+)═3[c(CO ![]() )+c(HCO
)+c(HCO ![]() )]
)]
③在0.1molL﹣1氨水中滴加0.1molL﹣1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH﹣)=10﹣amolL﹣1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO ![]() )均增大
)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH﹣)+c(H2S)+c(HS)
A.①④
B.②⑤
C.①③
D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】有一包粉末可能含有K+、Fe3+、Al3+、Cl﹣、SO42﹣、CO32﹣中的若干种,现进行以下实验:①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
②向①溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后,滤液呈中性,在滤液中滴入AgNO3溶液,有白色沉淀生成;
③取②中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
④重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
⑤向④的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤.往得到的沉淀中加入过量的NaOH溶液,沉淀减少.
(1)根据上述实验,这包粉末中一定不含有的离子是 , 肯定含有的离子是 , 不能确定是否含有的离子是 , 可通过实验来进一步确定该离子.
(2)写出⑤中生成有色沉淀反应的离子方程式:
(3)写出⑤中沉淀减少反应的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com