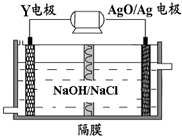
亚氯酸钠(NaClO
2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.某同学查阅资料后设计生产NaClO
2的主要流程如下.
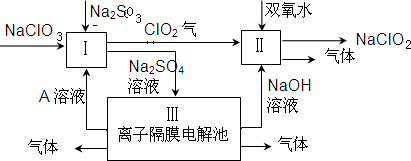
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是
Na2SO3
Na2SO3
、
H2O
H2O
(填化学式).
(2)Ⅱ中反应的离子方程式是
2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O
2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O
.
(3)A的化学式是
H2SO4
H2SO4
,装置Ⅲ中A在
阳
阳
极区产生.
(4)ClO
2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO
2+4HCl=5NaCl+4ClO
2↑+2H
2O.
①该反应中氧化剂和还原剂的物质的量之比是
1:4
1:4
.
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl
2的含量越大,运用氧化还原反应规律分析其原因是
ClO2-的氧化性或Cl-的还原性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2
ClO2-的氧化性或Cl-的还原性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2
.
(5)NaClO
2变质可分解为NaClO
3和NaCl.取等质量变质前后的NaClO
2试样均配成溶液,分别与足量FeSO
4溶液反应时,消耗Fe
2+的物质的量相同,从电子守恒的角度解释其原因是
NaClO2变质前后分别与Fe2+反应时,最终均得到等量NaCl,Cl元素均由+3价变为-1价,根据电子守恒,两个过程中得到的电子的物质的量相同
NaClO2变质前后分别与Fe2+反应时,最终均得到等量NaCl,Cl元素均由+3价变为-1价,根据电子守恒,两个过程中得到的电子的物质的量相同
.

 ),可用淀粉发酵法生产.
),可用淀粉发酵法生产.
 (2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.
(2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.