
科目: 来源: 题型:
【题目】磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)均是实验室常见试剂.已知:
SO2Cl2(g)SO2(g)+Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO(g)+Cl(g)+SCl(g)2SOCl(g) K2 △H=b kJ/mol (Ⅱ)
(1)反应:SO2Cl2(g)+SCl(g)2SOCl2(g)的平衡常数K=(用K1、K2表示),该反应△H=kJ/mol(用a、b表示).
(2)为研究不同条件对反应(Ⅰ)的影响,以13.5g SO2Cl2充入2.0L的烧瓶中,在101kPa 375K时,10min达到平衡,平衡时SO2Cl2转化率为0.80,则0~10minCl2的平衡反应速率为 , 平衡时容器内压强为 kPa,该温度的平衡常数为;若要减小SO2Cl2转化率,除改变温度外,还可采取的措施是(列举一种).
(3)磺酰氯对眼和上呼吸道粘膜有强烈的刺激性,发生泄漏时,实验室可用足量NaOH固体吸收,发生反应的化学方程式为;亚硫酰氯溶于水的离子方程式为 .
(4)一定量的Cl2用稀NaOH溶液吸收,若恰好反应,则溶液中各离子浓度由大到小的顺序为;已知常温时次氯酸的Ka=2.5×10﹣8则该温度下NaClO水解反应的平衡常数Kb=molL﹣1 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学用语表述正确的是( )
A.质量数为16的氧原子: ![]() O
O
B.漂白粉的有效成分:NaClO
C.Mg2+结构示意图: ![]()
D.钠在氧气中燃烧的化学方程式:4Na+O2 ![]() 2Na2O
2Na2O
查看答案和解析>>
科目: 来源: 题型:
【题目】磷单质及其化合物有广泛应用.
(1)磷酸二氢钙,广泛用于动物的饲料添加剂.目前其制备的新工艺方法有:石灰法:用石灰石中和磷酸,控制终点pH为3.2,既得磷酸二氢钙.请写出该反应的化学方程式;若有1×103kg石灰石最多能生产kg磷酸二氢钙.
(2)用石英、焦炭与磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的化学方程式为:4Ca5(PO4)3F+21SiO2+30C=3P4+20CaSiO3+30CO↑+SiF4↑:在此反应中,副产物矿渣可用来 .
(3)三聚磷酸可视为三个磷酸分子(磷酸结构简式如图 ![]() )之间脱去两个水分子的产物,其结构简式为 . 三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 .
)之间脱去两个水分子的产物,其结构简式为 . 三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 .
(4)次磷酸钠(NaH2PO2)可用于化学镀镍.化学镀镍的溶液中含有Ni2+和H2PO2﹣ , 在酸性条件下发生下述反应:请配平该反应离子方程式Ni2++H2PO2﹣+═Ni++H2PO3﹣+ .
(5)H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):①写出阳极的电极反应式 .
②分析产品室可得到H3PO2的原 . 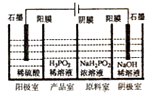
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验,验证元素周期律.
(1)甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞试液,依次加入大小相近的锂、钠、钾块,观察现象.①甲同学设计实验的目的是;
②反应最剧烈的烧杯是(填字母);
③写出b烧杯里发生反应的离子方程式 .
(2)乙同学设计实验验证:元素的非金属性越强,其最高价含氧酸的酸性就越强.他设计了如下图装置验证C、N、Si三种元素的非金属性强弱.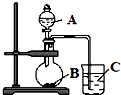
①写出所选用物质的化学式:A; B;C;
②写出圆底烧瓶中发生反应的离子方程式;
③写出烧杯中发生反应的离子方程式;
④碳、氮、硅三种元素的非金属性由强到弱顺序为;
(3)丙同学认为乙同学设计的实验不够严谨,应该在B和C之间增加一个洗气装置,该置中应盛放(填试剂).
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃,101kPa下,0.1molC2H2完全燃烧生成CO2和H2O(I)时放出129.96kJ热量.表示上述反应的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+129.96kJ
B.2C2H2(g)+5O2(g)→4CO2(g)+2H2O(g)﹣259.92kJ
C.2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)﹣1299.6kJ
D.2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+2599.2kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】利用某有机物之间的转换可以贮存太阳能,如降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为:  △H=+88.62kJ/mol
△H=+88.62kJ/mol
下列有关说法不正确的是( )
A.一定条件下,1mol NBD最多可与2 mol Br2发生加成反应
B.物质Q的能量比NBD的低
C.物质Q的一氯取代物只有3种
D.NBD和Q二者互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)配制0.50mol/L NaOH溶液
a.若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g.
b.从图中选择称量NaOH固体所需要的仪器是(填字母): .
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.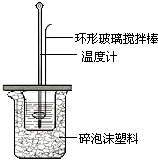
a.写出该反应的热化学方程式(中和热为57.3kJ/mol): .
b.取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式____________________________。
(2)碳的燃烧热为393.50 kJ·mol-1,写出表示C燃烧热的热化学方程式:______________。
(3)已知CO转化成CO2的能量关系如下图所示。写出该反应的热化学方程式:_______。
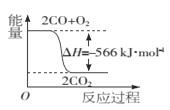
(4)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式________。
(5)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】将某些化学知识用数轴表示,可以收到直观、简明、易记的效果.用数轴表示的下列知识正确的是( )
A.硫及其化合物的化合价与氧化还原反应的关系: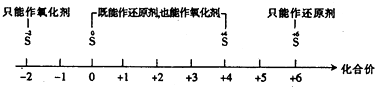
B.分散系的分类: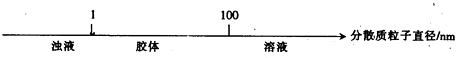
C.AlCl3溶液与NaOH溶液反应后铝元素的存在形式:
D.CO2与NaOH溶液反应后的产物![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】三位科学家因在烯烃复分解反应研究中的杰出贡献而荣获2005年度诺贝尔化学奖,烯烃复分解反应可示意如图: ![]()
下列化合物中,经过烯烃复分解反应可以生成  的是( )
的是( )
A.
B.
C.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com