
科目: 来源: 题型:
【题目】在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用.下图是生产亚氯酸钠的工艺流程图: 
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O;
②常温下,Ksp(FeS)=6.3×10﹣18;Ksp(CuS)=6.3×10﹣36;Ksp(PbS)=8×10﹣28
③Ⅲ装置中电解硫酸钠溶液,阳极区生成氧气同时产生硫酸,阴极区生成氢气同时产生氢氧化钠.
(1)I中发生反应的离子方程式为 .
(2)从滤液中得到NaClO23H2O晶体的所需操作依次是(填写序号).
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2 . 表是25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | H2CO3 | H2S |
Ka/molL﹣1 | 1×10﹣2 | 6.3×10﹣4 | K1=4.30×10﹣7 | K1=9.1×10﹣8 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为(用化学式表示);
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是;常温下,当最后一种离子沉淀完全时(该离子浓度为10﹣5molL﹣1)此时体系中的S2﹣的浓度为 .
(4)Ⅲ装置中若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( ) 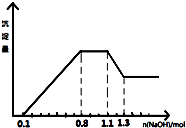
A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32﹣和NO3﹣ , 一定含有SO42﹣
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+):c(Al3+):c(Mg2+)=1:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( ) 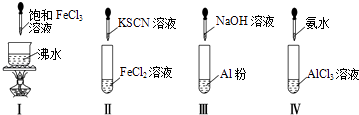
A.实验Ⅰ:产生红褐色沉淀
B.实验Ⅱ:溶液颜色变红
C.实验Ⅲ:放出大量气体
D.实验Ⅳ:先出现白色沉淀,后溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验.请回答下列问题:
Ⅰ.酸碱中和滴定﹣﹣已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液; ②准确量取25.00mL所配溶液于锥形瓶中;③滴加几滴酚酞溶液;④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
(1)用滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液.
(2)试样中NaOH的质量分数为 .
(3)若出现下列情况,测定结果偏高的是 .
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
(4)Ⅱ.氧化还原滴定﹣取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1molL﹣1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O.滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是
(5)Ⅲ.沉淀滴定﹣﹣滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母).
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10﹣10 | 5.35×10﹣13 | 1.21×10﹣16 | 1.12×10﹣12 | 1.0×10﹣12 |
A.NaCl
B.NaBr
C.NaCN
D.Na2CrO4 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于各图的说法,正确的是( ) 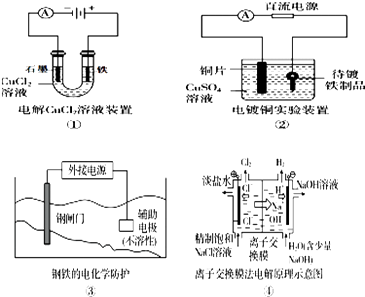
A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体
B.②中待镀铁制品应与电源正极相连
C.③中钢闸门应与外接电源的正极相连
D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.18 g H2O在标准状况下的体积是22.4 L
B.22.4 L O2中一定含有6.02×1023个氧分子
C.在标准状况时,20 mL NH3与60 mL N2所含的原子个数比为2:3
D.将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 moL/L
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组利用软锰矿浆(主费成分是MnO2)吸收工业要气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外。还含有少量Fe2+、Al3+、Ca2+等金属离子):

操作1的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
请回答下列问题:
(1)浸出过程中被氧化的物质的化学式为____________________________。
(2)氧化过程中主要反应的离子方程式_________________________________。
(3)在氧化后的液体中加入石灰浆调节pH,pH的范围是_____________________。
(4)操作1的名称是________,操作2包括蒸发浓缩、______过滤、洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200mL溶液。取20.00mL该溶液,向其中逐滴加入0.0500mol/L的FeSO4溶液,发生如下反应:Fe2++Mn3+=Fe3++Mn2+。当反应恰好完全进行时,共消耗FeSO4溶液19.50mL。通过计算确定MnSO4·H2O的纯度(写出计算过程)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是(用离子方程式表示).
(2)常温下,取0.2molL﹣1 HCl溶液与0.2molL﹣1 MOH溶液等体积混合,测得混合溶液后的pH=5.写出MOH的电离方程式: .
(3)0.1mol/L的NaHA溶液中,测得溶液中的显碱性.则
①该溶液中c(H2A)c(A2﹣)(填“>”、“<”或“=”).
②作出上述判断的依据是(用文字解释).
(4)含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10﹣3 molL﹣1的Cr2O72﹣ . 为了使废水的排放达标,进行如下处理: ![]()
①绿矾为FeSO47H2O.反应(I)中Cr2O72﹣与FeSO4的物质的量之比为 .
②常温下若处理后的废水中c(Cr3+)=6.0×10﹣7 molL﹣1 , 则处理后的废水的pH= . (Ksp[Cr(OH)3]=6.0×10﹣31)
查看答案和解析>>
科目: 来源: 题型:
【题目】白藜芦醇结构如右式,它广泛存在于食物(例如 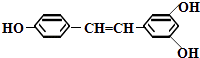 桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够与1mol该化合物起反应的Br2或H2的最大用量分别是( )
桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够与1mol该化合物起反应的Br2或H2的最大用量分别是( )
A.6mol,7mol
B.5mol,7mol
C.3.5mol,6mol
D.1mol,1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列物质:①碘水;②银氨溶液;③NaOH溶液;④稀硫酸;⑤浓硫酸。在进行淀粉的水解实验(包括检验水解产物及水解是否完全)时,除淀粉外,还需使用上述试剂或其中一部分,判断使用的试剂及其先后顺序为( )
A.④①③②
B.①④②③
C.⑤①③②
D.①⑤②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com