
科目: 来源: 题型:
【题目】对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图2: 
常温条件下的有关数据如表所示:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 颜色 | 水溶性 | |
对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g.
请回答下列问题:
(1)装置B的名称是 .
(2)量取6.00mL对氯甲苯应选用的仪器是 . (填选仪器序号).
A.10mL量筒
B.50mL容量瓶
C.50mL酸式滴定管
D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是 . 对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是 .
(4)第一次过滤的目的是 , 滤液中加入稀硫酸酸化,可观察到的实验现象是 .
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是 .
(6)本实验的产率是(填标号).
A.60%
B.70%
C.80%
D.90%
查看答案和解析>>
科目: 来源: 题型:
【题目】离子方程式CO32-+2H+=CO2↑+H2O可以表示
A. 碳酸盐与盐酸之间的反应 B. 一切碳酸盐与强酸之间的反应
C. 可溶性碳酸盐与强酸之间的反应 D. 碳酸盐与一切酸之间的反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A. 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
B. 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C. 除短周期外,其它周期均为18种元素
D. 周期表中所有元素都是从自然界中发现的
查看答案和解析>>
科目: 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液时,能造成所配溶液浓度偏低的原因是( )
A.定容时俯视液面
B.未洗涤烧杯和玻璃棒
C.容量瓶未干燥
D.转移溶液前溶液未冷却至室温
查看答案和解析>>
科目: 来源: 题型:
【题目】质量反应的离子方程式书写正确的是( )
A.氢氧化镁与稀盐酸反应:H++OH﹣═H2O
B.氯化钡溶液与硫酸钠溶液反应:Ba2++SO ![]() ═BaSO4↓
═BaSO4↓
C.FeCl3溶液中加入Fe粉:Fe3++Fe═2Fe2+
D.碳酸钠溶液与足量醋酸反应:Na2CO3+2H+═2Na++CO2↑+H20
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.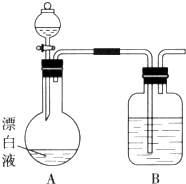
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO﹣具有氧化性.实验如下:Ⅰ.用pH试纸检验,漂白液pH>7,饱和KAl(SO4)2溶液pH<7.
Ⅱ.取10mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸.
Ⅲ.另取10mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色.
Ⅳ.再取10mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色.
①漂白液pH大于7的原因是(用离子方程式表示) .
②由实验Ⅱ得出ClO﹣具有氧化性,写出反应的离子方程式 .
③对比实验Ⅲ和Ⅳ说明ClO﹣氧化性与溶液酸碱性的关系是 .
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成.用如图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2 . ①装置B的作用是 .
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生.A中反应的离子方程式 .
③若打开分液漏斗活塞向烧瓶中加入饱和KAl(SO4)2溶液,首先观察到产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生.A中加KAl(SO4)2溶液反应的离子方程式是 .
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2 . 若取10mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,CO和CH4燃烧的热化学方程式分别为 2CO(g)+O2(g)═2CO2(g)△H=﹣566kJmol﹣1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJmol﹣1
由1mol CO(g)和3mol CH4(g)组成的混合气体在上述条件下充分燃烧,恢复至室温释放的热量为( )
A.2912kJ
B.2953kJ
C.3236kJ
D.3867kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
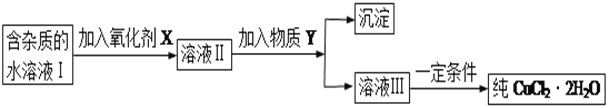
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.淀粉、纤维素及其水解产物均属于糖类
B.天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点
C.蛋白质溶液中加硫酸铵或氯化铜溶液,均会发生蛋白质的变性
D.糖类、油脂、蛋白质均能发生水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l);△H=+725.8 kJ/mol
O2(g)═CO2(g)+2H2O(l);△H=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=﹣1452 kJ/mol
C.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=﹣725.8 kJ/mol
D.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=+1452 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com