
科目: 来源: 题型:
【题目】在化学实验操作中必须注意安全操作,下列操作或事故处理正确的是( ) ①在点燃易燃性气体前,必须检验气体的纯度
②在稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌
③浓硫酸对皮肤有腐蚀性,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸液
④给试管中的液体加热时,液体体积不超过试管容积的三分之一
⑤点燃盛满酒精的酒精灯.
A.仅①②
B.仅①②③
C.仅①②④
D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】含CuSO4和H2SO4的混合溶液200mL,其中CuSO4物质的量浓度为1molL﹣1 , H2SO4物质的量浓度为0.5molL﹣1 , 若用此溶液配成0.2molL﹣1 CuSO4和2molL﹣1 H2SO4的混合溶液,试求:
(1)所得溶液的体积是多少毫升?
(2)需加入密度为1.84gcm﹣3、98%的浓硫酸多少毫升?
查看答案和解析>>
科目: 来源: 题型:
【题目】将可溶性碱A、盐B的溶液按如下程式进行实验,根据下述现象判断: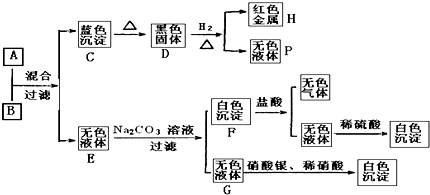
(1)A的化学式B的化学式 .
(2)完成下列转化的化学方程式,标明电子转移的方向和数目:D→H+P:
(3)写出F和盐酸反应的离子方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2= 4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH_____ (填“大”、“小”或“相等”);
(2)常温下将20 mL 0.4 mol/L的KOH溶液与20 mL 0.2 mol/L的草酸溶液混合,则混合后溶液中阴离子浓度的大小顺序为_______________________;
(3)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液20 mL,能否产生沉淀________(填“能”或“不能”).
(4)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000molL-1酸性KMnO4标准溶液滴定未知浓度的草酸。
①高锰酸钾溶液常用______(填“稀硫酸”、“稀硝酸”、“稀盐酸”)酸化,写出滴定过程中发生反应的离子方程式 _____________________________。
②滴定过程中操作滴定管的图示正确的是 ______________(填编号)。
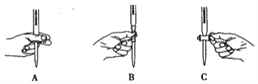
①判断滴定终点的方法是:_________________________________________。
②若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度________(填“偏高”或“偏低”或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影响。 | |
体积(mL) | 浓度 (molL-1) | ||||
1 | 25 | 0.5 | 4 | 0.1000 | |
2 | 50 | 0.5 | 4 | 0.1000 | |
3 | 25 | 0.5 | 4 | 0.0100 | |
4 | 25 | 0 | 4 | 0.1000 | |
①写出表中a 对应的实验目的_______________________;
②该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间(min) | ||
第1 次 | 第2 次 | 第3 次 | |
1 | 14.0 | 13.0 | 11.0 |
3 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有m g某气体,由双原子分子构成,摩尔质量为M gmol﹣1 . 若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为mol.
(2)该气体所含原子总数为个.
(3)该气体在标准状况下的体积为L.
(4)该气体在标准状况下的密度为g/L.
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为mol/L.
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下: 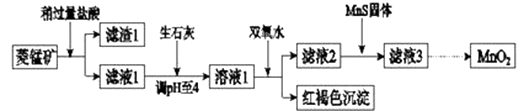
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1mol/L,回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是 . 盐酸溶解MnCO3的化学方程式是 .
(2)向溶液1中加入双氧水时,反应的离子方程式是 .
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+ , 反应的离子方程式是 .
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:Mn2++ClO3﹣+=++ .
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①阳极生成MnO2的电极反应式是 .
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2 . 检验Cl2的操作是 .
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列反应:①2BrO ![]() +Cl2=Br2+2ClO3﹣ ②5Cl2+I2+6H2O=2HIO3+10HCl ③ClO
+Cl2=Br2+2ClO3﹣ ②5Cl2+I2+6H2O=2HIO3+10HCl ③ClO ![]() +5Cl﹣+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序正确的是( )
+5Cl﹣+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序正确的是( )
A.ClO ![]() >BrO
>BrO ![]() >IO
>IO ![]() >Cl2
>Cl2
B.ClO ![]() >BrO
>BrO ![]() >Cl2>IO
>Cl2>IO ![]()
C.BrO ![]() >ClO
>ClO ![]() >Cl2>IO
>Cl2>IO ![]()
D.Cl2>BrO ![]() >ClO
>ClO ![]() >IO
>IO ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )

A. Ka(HA)=1×10-6mol/L
B. b点c (B+)=c(A-)=c(OH-)=c(H+)
C. c点时,![]() 随温度升高而减小
随温度升高而减小
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
科目: 来源: 题型:
【题目】t℃时,将3mol A 和1mol B气体,通入体积为2L的密闭容器(容积不变),发生反应:3A(g)+B(g)4C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始到达到平衡状态,生成C的平均反应速率为 .
(2)达到平衡状态时,B 物质的转化率α(B)= , 平衡常数K=(填计算结果).
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡(填字母)
A.向正反应方向移动
B.向逆反应方向移动
C.平衡不移动.
(4)若向原平衡中再充入a mol C,在t℃时达到新平衡,此时B的物质的量为:n (B)=mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间该满足的关系为: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com