
科目: 来源: 题型:
【题目】根据所学知识填空
(1)pH=2的HCl溶液稀释1000倍,所得溶液的PH
(2)pH=2的CH3COOH溶液稀释1000倍,所得溶液的PH范围
(3)pH=11的NaOH溶液稀释100倍,所得溶液的PH
(4)pH=11的NH3H2O溶液稀释100倍,所得溶液的PH范围
(5)pH=3和pH=5的两种盐酸溶液等体积混合,所得溶液PH
(6)pH=8和pH=13的两种氢氧化钠溶液等体积混合,所得溶液PH .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列水解反应的离子方程式书写正确的是( )
A.CO32﹣+2H2OH2CO3+2OH﹣
B.NH4++H2ONH3H2O+H+
C.Al3++3H2OAl(OH)3↓+H2O
D.HCO3﹣+H2OH3O++CO32﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)CH3OCH3(g)+H2O(g)△H=23.5kJmol﹣1 . 在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题: 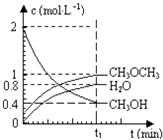
(1)该条件下反应平衡常数表达式K= . 在t1℃时,反应的平衡常数为 . 用CH3OH表示的化学反应速率 .
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4molL﹣1、c(H2O)=0.6molL﹣1、c(CH3OCH3)=1.2molL﹣1 , 此时正、逆反应速率的大小:v (正)v (逆)(填“>”、“<”或“=”).
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如图1所示. 
(1)为提高锌灰的浸取率,可采用的方法是(填序号).
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是(写化学式).
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S.
①检验ZnS固体是否洗涤干净的方法是 ,
②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取.化学反应方程式为
③已知Na2SO4 . 10H2O及Na2SO4的溶解度随温度变化曲线如图2.从滤液中得到Na2SO4.10H2O的操作方法是
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL,物质的量浓度为c mol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用.
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为t,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩.所建盐田分为贮水池、蒸发池和池.
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用:(写一点即可).
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示.其中具有选择性的阴离子交换膜和阳离子交换膜相间排列.请回答下面的问题:
①海水不能直接通人到阴极室中,理由是 .
②A口排出的是(填“淡水”或“浓水”)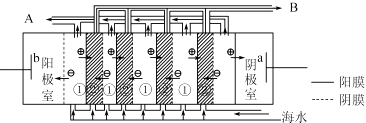
(3)用苦卤(含Na+、K+、Mg2+、Cl﹣、Br﹣等离子)可提取溴,其生产流程如下 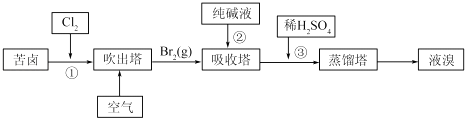
①若吸收塔中的溶液含BrO3﹣ , 则吸收塔中反应的离子方程式为:
②通过①氯化已获得含Br2的溶液.为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? .
③向蒸馏塔中通入水蒸气加热.控制温度在90℃左右进行蒸馏的原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Br-、Cl-、CrO42- B. Cl-、Br-、CrO42-
C. CrO42-、Br-、Cl- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,则下列说法中正确的是( )
A.80g硝酸铵含有氮原子数为2NA
B.标准状况下,22.4L CCl4所含分子数目为NA
C.常温常压下,32 g的O2和O3混合气体含有的原子数为2NA
D.8.4gNaHCO3溶解于水,电离生成的CO ![]() 数目为0.1NA
数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.常温下.NH4Cl溶液加水稀释, ![]() 增大
增大
B.0.1mol/LNa2CO3溶液加热后,溶液的pH减小
C.室温下稀释O.lmol/LCH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小
D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com