
科目: 来源: 题型:
【题目】下列表示物质结构的化学用语或说法中,正确的是( )
A.中子数为8的氮原子:8N
B.次氯酸的电子式: ![]()
C.PCl5分子的每个原子都满足8电子稳定结构
D.用电子式表示NaCl的形成过程: ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知向FeCl2溶液中滴加稀硝酸,溶液颜色由浅绿色变为棕黄色.某同学用此反应设计了如图所示原电池. 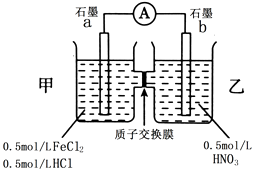
(1)写出FeCl2与稀硝酸反应的离子方程式 .
(2)图中电子流动方向为极到极.
(3)在乙烧杯中会观察到的现象为 , 写出乙烧杯中的电极反应方程式 .
(4)H+流向烧杯,若一段时间内流向该烧杯的H+有0.05mol,则消耗Fe2+g
(5)该装置存在的缺点可能是(写一点)
(6)若将乙烧杯的稀硝酸换成浓硝酸,写出a电极上的电极反应方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产.主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)。热化学方程式如下:①C3H6(g)+NH3(g)+ ![]() O2(g)═C3H3N(g)+3H2O(g)△H=﹣515kJmol﹣1 ②C3H6(g)+O2(g)═C3H4O(g)+H2O(g)△H=﹣353kJmol﹣1
O2(g)═C3H3N(g)+3H2O(g)△H=﹣515kJmol﹣1 ②C3H6(g)+O2(g)═C3H4O(g)+H2O(g)△H=﹣353kJmol﹣1
两个反应在热力学上趋势均很大,其原因是;有利于提高丙烯腈平衡产率的反应条件是;提高丙烯腈反应选择性的关键因素是 .
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃.低于460℃时,丙烯腈的产率(填“是”或“不是”)对应温度下的平衡转化率,判断理由是;高于460℃时,丙烯腈产率降低的可能原因是(双选,填标号).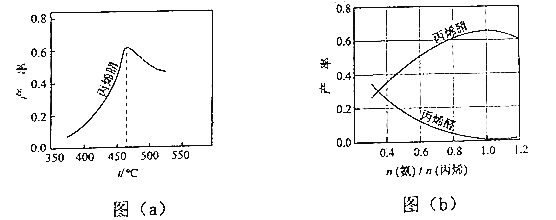
A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示.由图可知,最佳n(氨)/n(丙烯)约为 , 理由是 . 进料气氨、空气、丙烯的理论体积比约为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 钠、铁均是银白色金属,熔点高,硬度大
B. 实验室中,通常将钠保存在四氯化碳中
C. 钠在空气中燃烧产生黄色火焰
D. 高温时,铁与水蒸气反应生成氧化铁与氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】联氨(又称肼,N2H4 , 无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为 , 其中氮的化合价为 .
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 .
(3)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJmol﹣1
上述反应热效应之间的关系式为△H4= , 联氨和N2O4可作为火箭推进剂的主要原因为 .
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为(已知:N2H4+H+N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为 .
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 . 联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2 , 实验装置如图所示.当溶液pH约为4时,停止反应.在20℃静置结晶,生成Na2S2O5的化学方程式为:2NaHSO3═Na2S2O5+H2O.
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .
(2)装置Y的作用是 .
(3)析出固体的反应液经减压抽滤,洗涤,25℃﹣30℃干燥,可获得Na2S2O5固体.
①组成减压抽滤装置的主要仪器是布氏漏斗、和抽气泵.
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 .
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4 , 其可能的原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于金属的叙述中正确的是
A. 金属元素的原子只有还原性,离子只有氧化性
B. 含金属元素的离子不一定都是阳离子
C. “真金不怕火炼”是指金的熔点高
D. 金属元素单质在常温下均为固体
查看答案和解析>>
科目: 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况.请分析以下一组有现象变化的化学反应.
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 饱和Na2SlO3溶液(含2滴酚酞) | 先滴加1.0mL0.5molL﹣1NaOH溶液:再滴加1.5mL1.0molL﹣1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
0.1molL﹣1AlCl3溶液 | Ⅱ.加碱时 ;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
0.1molL﹣1Fe(NO3)2溶液 | Ⅲ.加碱时 ;加酸后溶液变为黄色 | ||
新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后无色溶液变为浅黄绿色 | ||
(1)用离子方程式解释现象I中出现胶状沉淀的原因: .
(2)II中加碱时出现的现象是 , 此现象说明溶液中发生反应的离子方程式是 .
(3)III中加碱时出现的现象是 .
(4)用离子方程式解释IV中加碱时出现的现象 .
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验.
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 0.1 molL﹣1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 molL﹣1 H2SO4溶液; | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL 0.1molL﹣1Fe(NO3)2溶液中 , 溶液立即变红,说明溶液中含Fe3+ , 证明加酸时溶液中发生了反应.
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1molL﹣1 Fe(NO3)2溶液中的Fe2+被NO3﹣氧化;
b.(用离子方程式表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去). 
(1)若A为强碱溶液,其焰色反应显黄色,C常用作食品添加剂,请回答下列问题:
①物质的量浓度相同的B、C水溶液的pH前者(填大于或小于)后者.
②反应Ⅲ的离子方程式是 .
③现有B和C的固体混合物ag,加热至质量不再改变时剩余固体为bg,则B的质量分数为 .
(2)若C、D均为金属单质,向A溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则:①反应 III的离子方程式是 .
②实验室中储存B溶液时应加入 .
③检验溶液A中金属阳离子的方法是 .
(3)若D为强电解质、B为难溶于水的沉淀,
①则A和C反应的离子方程式
②符合条件的D物质可能是下列物质中的(填序号).
a.硫酸 b.醋酸 c.氢氧化钠 d.氨水 e.氯化钡 f.硝酸镁.
查看答案和解析>>
科目: 来源: 题型:
【题目】[物质结构与性质]
[Zn(CN)4]2﹣在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2﹣+4H++4H2O═[Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基态核外电子排布式为 .
(2)1molHCHO分子中含有σ键的数目为mol.
(3)HOCH2CN分子中碳原子轨道的杂化轨道类型是 .
(4)与H2O分子互为等电子体的阴离子为 .
(5)[Zn(CN)4]2﹣中Zn2+与CN﹣的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2﹣的结构可用示意图表示为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com