
科目: 来源: 题型:
【题目】铝土矿的主要成分是Al2O3 , 含有杂质SiO2、Fe2O3、MgO.工业上从铝土矿中提取铝可采用如图所示工艺流程: 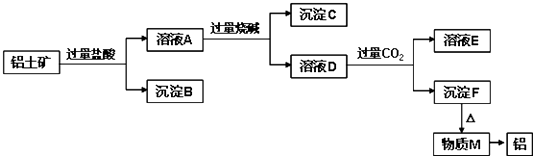
请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是(填操作名称).需要用到的玻璃 仪器、、
(2)沉淀B的成分是(填化学式,下同),沉淀C的成分是、;
(3)写出生成溶液D的离子方程式;
(4)沉淀F转化为物质M的化学方程式为;溶液D中通入过量CO2生成沉淀F的离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】非金属单质A经图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题: A ![]() B
B ![]() C
C ![]() D
D
(1)若A在常温下为固体单质,B是能使品红溶液褪色的有刺激性气味的无色气体. ①写出B→C的化学方程式
②写出D→B的化学方程式
(2)若A在常温下为气体单质,C是红棕色气体. ①A、C的化学式分别是:A;C .
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式 .
(3)若A在常温下为非金属气态氢化物,C是红棕色气体.写出实验室制取A气体的化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】今有Na2CO3、NaHCO3、NaCl组成的混合物100g,加热到质量不再减少为止。剩余残渣为84.5g,将残渣溶于水,滴入足量的AgNO3溶液得到白色沉淀,加足量的稀硝酸后大部分沉淀消失,剩余沉淀为12.26g,试计算混合物中Na2CO3、NaHCO3和NaCl的质量分数各是多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】“套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两支或更多试管进行的实验。因其有许多优点,近年来被广泛开发并应用于化学实验中。下面这个实验为“套管实验”,实验装置如图,小试管中部有沾上无水硫酸铜粉末的脱脂棉。请观察实验装置,分析实验原理,并回答下列问题: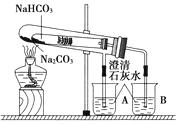
(1)整个实验过程中,能观察到的现象为:
①烧杯A中;②小试管中;
③烧杯B中;
(2)实验结束时,在操作上要特别注意的问题是?
(3)写出实验过程中发生反应的化学方程式。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有中学化学中常见的几种物质:①O2、②Mg、③CO、④WO3、⑤W、⑥CO2。 请回答下列问题:
(1)①、②、③、④四种物质中常用作还原剂的有(填序号)。
(2)请将③、④、⑤、⑥对应物质填入下列横线上,以组成一个氧化还原反应化学方程式: +=+
(3)随着人们环保意识的增强,许多汽车都已经装上了如图所示的尾气处理装置。在催化剂的作用下,尾气中两种主要的有毒气体反应生成两种无害气体,两种无害气体均为空气中的成分,写出该反应的化学方程式: 。该反应中是氧化剂。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化工专家侯德榜的侯氏制碱法为世界制碱工业作出了突出贡献。他以NaCl、NH3、CO2等为原料制得NaHCO3 , 进而生产出纯碱,有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3![]() Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是________(填字母标号)。
A.碳酸氢钠难溶于水
B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方法实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出):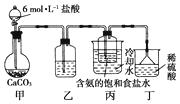
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是;
(Ⅱ)丁装置中稀硫酸的作用是。
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是(填分离操作的名称)。
②另一位同学用下图中戊装置(其他装置未画出)进行实验: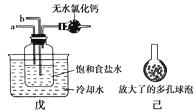
(Ⅰ)实验时,须先从管通入气体,再从管通入气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,原因是。
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列短周期元素性质的数据:下列关于表中11种元素的说法正确的是( )
元素 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
原子半径(10﹣10m) | ﹣ | 0.37 | 0.74 | 0.75 | 0.77 | 0.82 | 0.99 | 1.10 | 1.52 | 1.60 | 1.86 |
最高或最 | 0 | +1 | +5 | +4 | +3 | +7 | +5 | +1 | +2 | +1 | |
﹣2 | ﹣3 | ﹣4 | ﹣1 | ﹣3 |
A.上表中11种元素中形成的非金属单质都有非极性共价键
B.②⑨处于同一周期,④⑧处于同一主族
C.上表中11种元素中最高价氧化物对应的水化物中⑦号酸性最强
D.⑥原子结构示意图为 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com