
科目: 来源: 题型:
【题目】黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。
已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 , 放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式?
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为L,制得98%的硫酸质量为t,SO2全部转化为H2SO4时放出的热量是kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】构建和谐社会的内容之一是人类与环境的和谐发展,而“绿色化学”的内容是指从技术经济上设计可行的化学反应,尽可能减少对环境的副作用,下列化学反应不符合“绿色化学”概念的是( )
A.消除硫酸厂尾气中的SO2:SO2+2NH3+H2O===(NH4)2SO3
B.消除硝酸工业尾气的氮氧化物的污染:NO+NO2+2NaOH===2NaNO2+H2O
C.制CuSO4:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.制CuSO4:2Cu+O2+2H2SO4 ![]() 2CuSO4+2H2O
2CuSO4+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】已知90℃时,Kw =1.0×10-12,在90℃将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得溶液pH=7,则NaOH溶液与硫酸溶液的体积比为
A.1:9B.9:1C.10:1D.1:10
查看答案和解析>>
科目: 来源: 题型:
【题目】以氢气、一氧化碳为主要成分,供化学合成的一种气体叫合成气。工业上通过“天然气蒸气转化”反应来得到合成气,其反应为:CH4+H2O(g) ![]() CO+3H2(正反应为吸热反应)。工业上通过采用合适的温度和压强、适宜的催化剂以及合适的CH4和H2O配比来获得最佳的生产效率。对于转化反应的有关叙述正确的是( )
CO+3H2(正反应为吸热反应)。工业上通过采用合适的温度和压强、适宜的催化剂以及合适的CH4和H2O配比来获得最佳的生产效率。对于转化反应的有关叙述正确的是( )
A.增大压强,有利于得到更多的合成气
B.反应温度越低,越有利于合成气的生产
C.工业生产中采用加入过量水蒸气的方法来提高甲烷的利用率
D.工业生产中使用催化剂的目的在于提高甲烷的利用率
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室模拟合成氨和氨催化氧化的流程如下: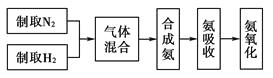
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。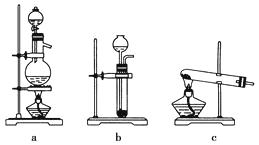
(1)从上图中选择制取气体的合适装置:氮气、氢气。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有、。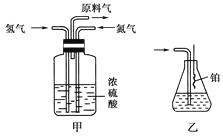
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,(“会”或“不会”)发生倒吸;原因是。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是 ,
锥形瓶中还可观察到的现象是。
(5)写出乙装置中氨氧化的化学方程式:。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、、。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)C(g)+D(g)已达到平衡状态( ) ①混合气体的压强
②混合气体的质量
③各气体物质的物质的量浓度
④气体的总物质的量
⑤混合气体的平均相对分子质量.
A.①②③
B.②③⑤
C.②③④⑤
D.①③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语.下列有关化学用语的表示方法中正确的是( )
A.硫原子的原子结构示意图: ![]()
B.NH4Cl的电子式: ![]()
C.原子核内有10个中子的氧原子: ![]() O
O
D.用电子式表示氯化氢分子的形成过程: ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图。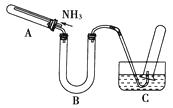
材料一 NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物。如:2NH3+3CuO ![]() 3Cu+N2+3H2O;
3Cu+N2+3H2O;
材料二 Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu,Cu2O+2H+=Cu2++Cu+H2O。
请回答下列问题:
(1)在实验室里,该学习小组设计下列制取纯净干燥氨气的方案,简易、可行的最佳方案是________。
A.加热氯化铵固体,再通过碱石灰
B.在N2和H2的混合气体中加入铁触媒,并加热至500 ℃,再通过碱石灰
C.加热浓氨水,再通过碱石灰
D.在生石灰中加入浓氨水,再通过碱石灰
(2)为证明NH3还原CuO的反应中有水生成,B中应放入的试剂是。
(3)当观察到(填现象),即表明A中的反应已经完成。
(4)该小组欲用体积比为1∶4的稀硫酸作试剂,检验反应是否有Cu2O固体生成。现用98%的浓硫酸配制1∶4的稀硫酸,所需的玻璃仪器除了胶头滴管外还有。
可证明还原产物中含有Cu2O的操作及现象是。
(5)请写出A中生成Cu2O的化学方程式。
(6)若用定量的方法测定该反应是否生成Cu2O,最简便且准确的方法是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com