
科目: 来源: 题型:
【题目】参考下列①~③项回答问题:
①皂化值是使1g油脂皂化所需要的氢氧化钾的毫克数;
②碘值是使100g油脂加成时消耗单质碘的克数;
③各种油脂的皂化值、碘值列表如下:
花生油 | 亚麻仁油 | 牛油 | 黄油 | 硬化大豆油 | 大豆油 | |
皂化值 | 190 | 180 | 192 | 226 | 193 | 193 |
碘值 | 90 | 182 | 38 | 38 | 5 | 126 |
(1)单纯油(C17H33COO)3C3H5(相对分子质量884)形成的油,用氢氧化钾皂化时,皂化值为?
写出其反应方程式?
(2)在下列①~④的空格内填入适当的词句。
①亚麻仁油比花生油所含的脂肪酸多(填写“饱和”或“不饱和”);
②黄油比牛油所含的脂肪酸多(填写“低级”或“高级”);
③硬化大豆油的碘值小的原因是;
④不同油脂的皂化值越大,则油脂的平均相对分子质量;碘化值越高,则表明含越多。
(3)为使碘值为180的100g鱼油硬化,所需氢气的体积在标准状况下为多少升?
(4)用下列结构式所代表的酯,若皂化值为430,求n为多少?并完成下面反应方程式: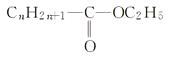 +KOH―→+
+KOH―→+
查看答案和解析>>
科目: 来源: 题型:
【题目】元素性质呈现周期性变化的根本原因是( )
A.元素原子电子层数增大
B.元素原子最外层电子数呈现周期性变化
C.元素的化合价呈现周期性变化
D.核电荷数依次增大
查看答案和解析>>
科目: 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是
物质 | 试剂 | 分离方法 | |
① | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
③ | 乙醇(水) | 生石灰 | 蒸馏 |
④ | 苯(苯酚) | 浓溴水 | 分液 |
A.①②B.只有③C.①③D.③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为﹣285.5kJ/mo1,则电解水的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+285.5kJ/mo1
B.1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,则它的热化学方程式为: ![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(1)△H=﹣445kJ/mol
CO2(g)+H2O(1)△H=﹣445kJ/mol
C.已知:2C(s)+O2(g)=2CO(g)△H=﹣221 kJmol﹣1 , 则C的燃烧热为﹣110.5kJ/mo1
D.HF与NaOH溶液反应:H+(aq)+OH﹣(aq)=H2O(1)△H=﹣57.3kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+ ![]() O2(g)
O2(g) ![]() 2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO3分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为。
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO3分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸收塔中反应物之间是怎样对流的。。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可).
查看答案和解析>>
科目: 来源: 题型:
【题目】除去下列物质中的杂质,所用试剂和方法不正确的是 ( )
物质 | 杂质 | 除杂质所用试剂和方法 | |
A | KCl溶液 | I2 | CCl4,萃取 |
B | KNO3 | K2SO4 | Ba(NO3)2溶液,过滤 |
C | Cu | CuO | 盐酸,过滤 |
D | CaCO3 | CaO | 盐酸,过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图1: 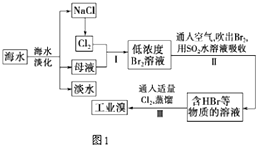
(1)请列举海水淡化的两种方法:、 .
(2)步骤I中己获得Br2 , 步骤II中又将Br2还原为Br﹣ . 其目的是 .
(3)步骤II用SO2水溶液吸收Br2 , 吸收率可达95%.有关反应的离子方程式为 .
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法.查阅了有关资料知:Br2的沸点为59℃.微溶于水,有毒并有强腐蚀性.他们参观生产过程后.画了如图2装置简图: 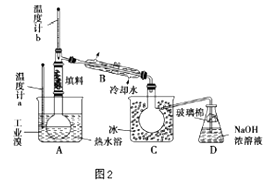
请你参与分析讨论:
①图中仪器B的名称是 .
②整套实验装皿中仪器连接均不能用橡胶塞和橡胶管.其原因是 .
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件? .
④C中液体颜色为 . 为除去该产物中仍残留的少量Cl2 , 可向其中加入NaBr,溶液,充分反应后.再进行的分离操作是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。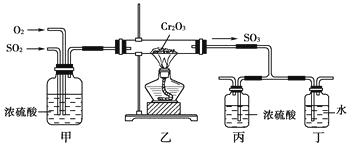
试填写下列空白:
(1)写出工业上用FeS2制取SO2的化学方程式:。
(2)写出上图中部分装置的作用:①甲;
②丙和丁:。
(3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸中的导管插入太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾:②。
(4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于;丙和丁相当于。
(5)在硫酸工业制法中,下列对生产操作与说明生产操作的主要原因的叙述都正确的是________(填下列选项的序号)。
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化碳会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸溶液吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
查看答案和解析>>
科目: 来源: 题型:
【题目】石膏也可用于工业生产二氧化硫,进而生产硫酸。天然石膏的化学式为CaSO4·2H2O。将天然石膏脱水后,第2步化学反应就可制得二氧化硫。
(1)写出第1步反应的化学方程式。
(2)在第2步化学反应中,下列原料可以使用的是(用序号填空)。写出有关化学反应的方程式。
①空气 ②氧气 ③硫酸 ④焦炭
(3)在第2步化学反应中,可能会排入空气的气态污染物是。它(或它们)的主要危害是。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组混合物,不能用分液漏斗分开的是 ①四氯化碳、水②乙醇、甘油③乙醇、水④苯、水⑤已烷、水⑥环已烷、苯⑦溴苯、水
A.①②③B.②③⑥C.①④⑤⑦D.④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com