
科目: 来源: 题型:
【题目】某同学欲配制100mL 0.10molL﹣1的CuSO4溶液.以下操作1~5是其配制的过程及示意图: 
操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解.
操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中.
操作3:继续向X中加蒸馏水至液面 离X的刻度线l~2cm处.
操作4、操作5:见图
(1)仪器X的名称是;
(2)操作1中,应称取胆矾晶体的质量为;
(3)若其余操作步骤均正确,根据操作4所配的溶液浓度选填“偏大”、“偏小”、“不影响”或“无法判断”).
查看答案和解析>>
科目: 来源: 题型:
【题目】在“HI(s) → HI(g) → H2和I2”的变化过程中,被破坏的作用力依次是
A. 分子间作用力、分子间作用力B. 分子间作用力、共价键
C. 共价键、离子键D. 共价键、共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。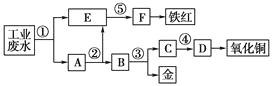
填写下面空白。
(1)图中标号处需加入的相应物质分别是①、②、③、④、⑤;
(2)写出①处发生反应的离子方程式;
写出③处发生反应的化学方程式;
(3)铁红的化学式为;分别写出铁红和氧化铜在工业上的一种主要用途:铁红;氧化铜。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲同学进行了FeCl2溶液的配制、浓度的测定以及Fe2+还原性的实验,并针对异常现象进行探究.
(1)步骤一:制取FeCl2 甲同学准备用两种方案制取.
方案1:按如图装置用H2还原无水FeCl3制取.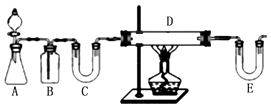
E中盛放的试剂是;D中反应的化学方程式为 . 此方案有个明显的缺陷是 .
方案2:由0.1molL﹣1 FeCl3溶液制取FeCl2溶液,你认为其操作应该是 .
(2)步骤二:测定方案2所配FeCl2溶液的物质的量浓度.用重铬酸钾法(一种氧化还原滴定法)可达到目的.若需配制浓度为0.01000molL﹣1的K2Cr2O7标准溶液480mL,实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少 ,
本实验滴定过程中操作滴定管的图示正确的是(填编号).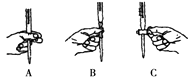
下列错误的操作使测定的FeCl2溶液浓度偏小的是
A.若在配制K2Cr2O7标准溶液定容时采取俯视姿势
B.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失.
C.锥形瓶洗净后未干燥
(3)步骤三:向2mL FeCl2溶液中滴加2滴0.1molL﹣1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5molL﹣1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
甲同学探究“步骤三”中溶液褪色的原因:
实验I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
实验II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀,并测得生成了两种可直接排放到空气中的气体.
实验III.向2mL 0.1molL﹣1 FeCl3溶液中滴加2滴0.1molL﹣1KSCN溶液,变红,通入O2 , 无明显变化.
①实验I说明溶液红色褪去是因为SCN﹣发生了反应而不是Fe3+发生反应.
②实验III的目的是 .
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN﹣氧化成SO42﹣和相关气体.写出该反应的离子方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 由非金属元素组成的化合物一定是共价化合物
B. 构成单质分子的微粒中不一定含有化学键
C. 在水中氢、氧原子间均以共价键相结合
D. 由于 H—O 键比 H—S 键牢固,所以H2O 的熔沸点比H2S 高
查看答案和解析>>
科目: 来源: 题型:
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用.CeO2在稀硫酸和H2O2的作用下可生成Ce3+ , CeO2在该反应中作剂.
(2)自然界Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬.完成并配平下列离子方程式:
Cr2O72﹣+SO32﹣+=Cr3++SO42﹣+H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 .
(4)NiSO4xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下: 
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是 .
③滤液Ⅲ溶质的主要成分是NiSO4 , 加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4 , 这两步操作的目的是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】微粒间的作用力主要有离子键、共价键、金属键(存在于金属单质与合金中)、一般的 分子间作用力和氢键,下列各组物质中,所含有的相互作用力类型最多的一组是
A. Na2O2 Na2OB. KClO CO2C. K HBrD. HF NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】水的三态的熵值的大小关系正确的是( )
A.S(s)>S(l)>S(g)
B.S(l)>S(s)>S(g)
C.S(g)>S(l)>S(s)
D.S(g)>S(s)>S(l)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对水体污染物的处理方法中,不正确的是
A.含盐酸的酸性废水用中和法处理B.含Cu2+、Fe3+的废水用沉淀法处理
C.含有细菌的污水用臭氧杀菌D.含有重金属离子的废水用明矾处理
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:C(s,金刚石)=C(s,石墨)△H=﹣1.9KJ/mol
C(s,金刚石)+O2(g)=CO2(g)△H1
C(s,石墨)+O2(g)=CO2(g)△H2
根据已述反应所得出的结论正确的是( )
A.△H1=△H2
B.△H1>△H2
C.△H1<△H2
D.金刚石比石墨稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com