
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 现有分子式为C9H8O2Br2的物质M,在一定条件下可发生下图所示一系列反应(已知有机物A的相对分子质量为60):
现有分子式为C9H8O2Br2的物质M,在一定条件下可发生下图所示一系列反应(已知有机物A的相对分子质量为60):








查看答案和解析>>
科目: 来源: 题型:
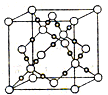 已知A、B、C、D、E五种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子.查看答案和解析>>
科目: 来源: 题型:
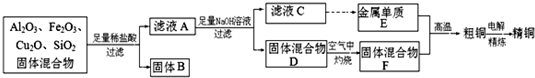
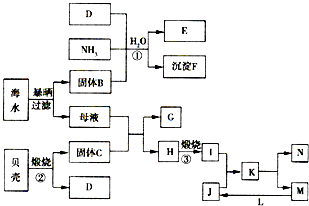 [化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).
[化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
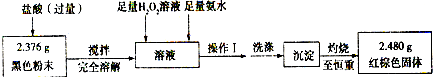
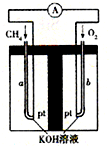
 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉.现用下图中甲、乙两套仪器装置制取上述铁的氧化物和细铁粉.制取上述铁的氧化物和细铁粉时必须使用普通铁粉和6mol?L-1盐酸,其他试剂任选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热装置等以及仪器中所装的试剂在图中均已略去).
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉.现用下图中甲、乙两套仪器装置制取上述铁的氧化物和细铁粉.制取上述铁的氧化物和细铁粉时必须使用普通铁粉和6mol?L-1盐酸,其他试剂任选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热装置等以及仪器中所装的试剂在图中均已略去).
| ||
| ||

查看答案和解析>>
科目: 来源: 题型:阅读理解
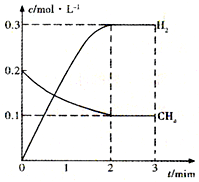 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.| t/min | n(CH4)/mol | n(H2O)/mol | n(CO)/mol | n(H2)/mol |
| 4 | 0.18 | 0.38 | 0.22 | 0.66 |
| n(CH4) |
| n(H2O) |
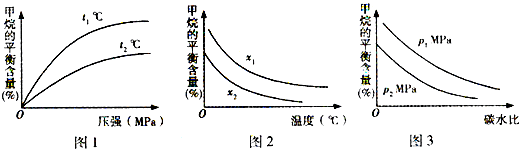
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com