
科目: 来源: 题型:
【题目】磷是生物体中不可缺少的元素之一,它能形成多种化合物. 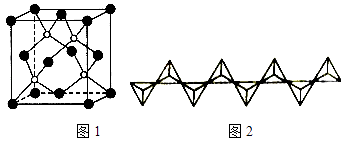
(1)基态磷原子中,电子占据的最高能层符号为;该能层中电子占据的能量最高的电子云在空间有个伸展方向,原子轨道呈形.
(2)磷元素与同周期相邻两元素相比,第一电离能由大到小的顺序为 .
(3)单质磷与Cl2反应,可以生成PCl3和PCl5 . 其中各原子均满足8电子稳定结构的化合物中,P原子的杂化轨道类型为 , 其分子的空间构型为 .
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图1为其晶胞,硼原子与磷原子最近的距离为acm.用Mg/mol表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度为 .
(5)H3PO4为三元中强酸,与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+ . 基态Fe3+的核外电子排布式为;PO43﹣作为为Fe提供 .
(6)磷酸盐分为直链多磷酸盐、支链状超磷酸盐和环状聚偏磷酸盐三类.某直链多磷酸钠的阴离子呈如图2所示的无限单链状结构,其中磷氧四面体通过共用顶角氧原子相连.则该多磷酸钠的化学式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
A.常温常压下,8gCH4中含有的氢原子数为2NA
B.含有NA个氦原子的氦气在标准状况下的体积约为22.4L
C.常温常压下,48氧气和臭氧(O3)混合物中所含氧原子总数为3NA
D.物质的量浓度为0.5 molL﹣1的MgCl2溶液中,含有Cl﹣个数为1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】E是一种治疗心血管疾病的药物,它的合成路线如下: 
(1)C分子中含氧官能团的名称为 .
(2)由B→C的反应类型为 .
(3)由A制备B的过程中有少量副产物F,它与B互为同分异构体,F的结构简式为 .
(4)写出同时满足下列条件的D的一种同分异构体的结构简式: . ①属于α﹣氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子.
(5)已知乙烯在催化剂作用与氧气反应可以生成环氧乙烷( ![]() ). 写出以邻甲基苯酚 (
). 写出以邻甲基苯酚 (  )和乙醇为原料制备
)和乙醇为原料制备  的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
合成路线流程图示例如下:H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.鸡蛋壳溶于食醋:CaCO3+2CH3COOH→(CH3COO)2Ca+H2O+CO2↑
B.苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O﹣→2C6H5OH+CO32﹣
C.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH﹣ ![]() CH2BrCOO﹣+H2O
CH2BrCOO﹣+H2O
D.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH﹣ ![]() CH3COO﹣+NH4++3NH3+2Ag↓+H2O
CH3COO﹣+NH4++3NH3+2Ag↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用下列两种方法制氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87gMnO2与足量浓盐酸反应.所得的氯气( )
A.①比②多
B.②比①多
C.一样多
D.无法比较
查看答案和解析>>
科目: 来源: 题型:
【题目】将标准状况下22.4L的HCl溶于水配成200mL的溶液,所得溶液的物质的量浓度为;同温、同压下等质量的NO2和NO气体,它们所占的体积比为 , 所含氧元素的物质的量之比为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】在C2H2、C6H6、C2H4O组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数是( )
A.92.3%
B.87.6%
C.75%
D.84%
查看答案和解析>>
科目: 来源: 题型:
【题目】综合利用CO2对环境保护及能源开发意义重大. 
(1)Li2O、Na2O、MgO均能吸收CO2 . 如果寻找吸收CO2的其他物质,下列建议合理的是 . a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(2)利用反应A可将释放的CO2转化为具有工业利用价值的产品.反应A:CO2+H2O ![]() CO+H2+O2已知:如图1所示,则反应A的热化学方程式是 .
CO+H2+O2已知:如图1所示,则反应A的热化学方程式是 .
(3)高温电解技术能高效实现(3)中反应A,工作原理示意图如图2: ①电极b发生(填“氧化”或“还原”)反应.
②CO2在电极a放电的反应式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】NiSO46H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下: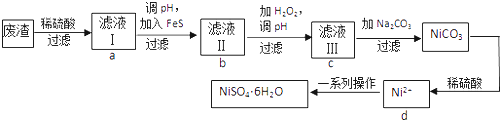
(1)向滤液Ⅰ中加入FeS是为了生成难溶于酸的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为: .
(2)对滤液Ⅱ的操作,请回答:
①往滤液Ⅱ中加入H2O2的离子方程式: .
②调滤液ⅡpH的目的是除去Fe3+ , 其原理是Fe3++3H2OFe(OH)3+3H+ , 已知25℃时Ksp[Fe(OH)3]=2.8×10﹣39 , 则该温度下上述反应的平衡常数K=
③检验Fe3+是否除尽的操作和现象是 .
(3)滤液Ⅲ溶质的主要成分是NiSO4 , 加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4 , 这两步操作的目的是 .
(4)得到的NiSO4溶液经一系列操作可得到NiSO46H2O晶体,请回答:
①一系列操作主要包括、、等操作.
②为了提高产率,过滤后得到的母液要循环使用,则应该回流到流程中的位置.(填a、b、c、d)
③如果得到产品的纯度不够,则应该进行操作(填操作名称).
查看答案和解析>>
科目: 来源: 题型:
【题目】将 ![]() 转变为
转变为 ![]() 的方法为( )
的方法为( )
A.与足量NaOH溶液共热后,再通入CO2
B.与足量NaOH溶液共热后,再加入稀硫酸
C.与稀硫酸共热后,加入足量NaOH溶液
D.与足量稀硫酸共热后,加入足量Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com