
科目: 来源: 题型:
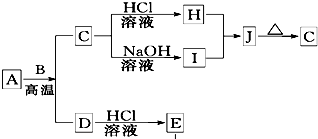 B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.
B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:阅读理解
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目: 来源: 题型:
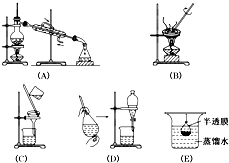 某研究性学习小组进行了Fe(OH)3胶体的制备:将饱和三氯化铁溶液滴入沸水中,加热至液体变为红褐色,得到Fe(OH)3胶体.用此分散系进行实验:
某研究性学习小组进行了Fe(OH)3胶体的制备:将饱和三氯化铁溶液滴入沸水中,加热至液体变为红褐色,得到Fe(OH)3胶体.用此分散系进行实验:查看答案和解析>>
科目: 来源: 题型:
 向含Al2(SO4)3 和 AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
向含Al2(SO4)3 和 AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com