
科目: 来源: 题型:
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
(1)Ti基态原子的电子排布式为
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物.电负性:C(填“>”或“<”,下同)B;第一电离能:NO,原因是 .
(3)月球岩石﹣﹣玄武岩的主要成分为钛酸亚铁(FeTiO3).FeTiO3与80%的硫酸反应可生成TiOSO4 . SO42﹣的空间构型为形,其中硫原子采用杂化,写出SO42﹣的一种等电子体的化学式:
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3 , CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点).该晶体中,Ti4+和周围个O2﹣相紧邻. 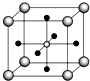
(5)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型.晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响.由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3 , 晶胞边长为4.28×10﹣10 m,则FexO中x=(用代数式表示,不要求算出具体结果).
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D均为中学化学中的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去): A ![]() B
B ![]() C
C ![]() D
D
(1)若A能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的石蕊试纸变红,则C为(填化学式).写出A→B的化学反应方程式: .
(2)若B能使品红溶液褪色,则D的化学式为 . 下列有关B的说法中正确的是(填序号). a.燃烧化石燃料不会产生B
b.造纸过程中可用B漂白纸浆
c.紫色石蕊试液遇B的水溶液会变红
d.可在葡萄糖中添加大量B作杀菌剂
(3)若A为活泼金属元素的单质,C为淡黄色固体,则B的化学式为;写出C→D的离子反应方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列四种物质 
(1)能发生消去反应生成具有相同碳原子数的烯烃的是 , 写出消去产物的结构简式: .
(2)能被氧化生成具有相同碳原子数的醛或酮的是 , 写出氧化产物的结构简式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl36H2O)的工艺流程如图: 
回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是 . 该反应的化学方程式 , 该反应中被氧化的元素是 .
(2)酸溶及后续过程中均需保持盐酸过量,其目的是、;
(3)操作a为蒸发浓缩、冷却结晶、、、干燥,获得FeCl36H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
0.1 | 0.5 | 1 | 10 | |
400 | 99.2% | 99.6% | 99.7% | 99.9% |
500 | 93.5% | 96.9% | 97.8% | 99.3% |
600 | 73.7% | 85.8% | 89.5% | 96.4% |
根据表中的数据判断该反应的正向属于(填“放热“或”吸热“)反应,理由是 .
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为吨(假设反应过程中硫的损失率为5%,结果保留一位小数).
查看答案和解析>>
科目: 来源: 题型:
【题目】膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( ) 
A.芥子醇的分子式是C11H12O4
B.芥子醇分子中所有碳原子可能在同一平面
C.1mol芥子醇能与足量溴水反应消耗3molBr2
D.1mol芥子醇与足量的氢气反应消耗氢气4mol
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在日常生活、生产中应用广泛.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,工业上利用NaClO 和NaOH的混合溶液将Fe(OH)3氧化性制备高铁酸钠,反应的化学方程式为;高铁酸钠能用作新型净水剂的原理是;(用离子方程式表示).
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: 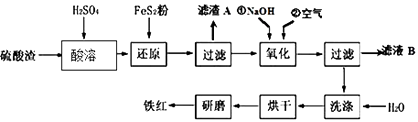
①酸溶过程中发生反应的化学方程式为 , , ;“滤渣A”主要成份的化学式为 .
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+ , 而本身被氧化为H2SO4 , 请写出该反应的离子方程式;
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组制取氯气并进行氯气的性质实验,其装置如图所示,请回答下列问题: 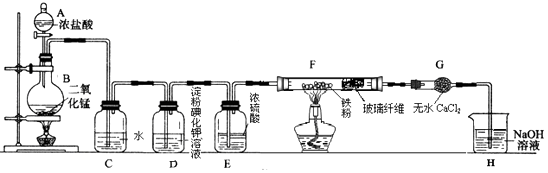
(1)仪器A的名称是 . 实验中制备氯气的反应方程式为 .
(2)C中发生反应的化学方程式为 . 若将干燥的有色布条放入C中,观察到的现象是 , 原因是 .
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,写出D装置中发生反应的离子方程式 .
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解,100℃左右时升华.双通管F中玻璃纤维(不参与反应)的作用是;在F和H装置之间安装G装置的目的是 .
(5)H中NaOH溶液的作用是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】根据反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
(1)用双线桥法表示电子转移的方向和数目. Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
(2)氧化产物是 , 还原产物是 .
(3)氧化剂与还原剂的物质的量之比为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)有下列物质:①铜;②石灰水;③CO2;④Na2SO4固体;⑤CaO.其中属于混合物的是(填序号,下同),属于碱性氧化物的是;写出Na2SO4在水溶液中的电离方程式: .
(2)如图装置中仪器①的名称是 , 水流的方向是从(填“a”或“b”)口进入. 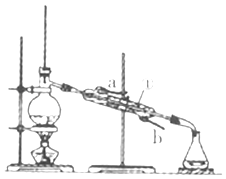
(3)实验室常用(填试剂)检验Fe3+的存在,现象是 .
(4)19g MgCl2中Mg2+的物质的量是mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
A.0.1 mol癸烷分子中,共价键数为3 NA
B.1 mol乙醇在O2中完全燃烧,电子转移数目为6 NA
C.标准状况下,22.4 L甲醇中含有的氧原子数为1.0 NA
D.室温下,26.0 g乙炔和苯乙烯的混合物中含有的碳原子数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com