
科目: 来源: 题型:
【题目】常温下,FeS的Ksp=6.25×10﹣18(设饱和溶液的目睹为1g/mL),若已知H2S饱和溶液在常温下,c(H+)与c(S2﹣)之间存在以下关系:c2(H+)c(S2﹣)=1.0×10﹣22 , 该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)达到1mol/L,应调节溶液的pH= .
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家对土星的最大卫星——土卫六的探测数据分析发现,土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其它碳氢化合物。关于甲烷和碳氢化合物的叙述错误的是
A. 甲烷是含碳量最低的碳氢化合物
B. 所有的碳氢化合物分子组成均符合Cn H2n+2的通式
C. 碳氢化合物均不溶于水
D. 碳氢化合物分子中的化学键一定有极性键,也可能有非极性键
查看答案和解析>>
科目: 来源: 题型:
【题目】质量分数为a%,物质的量浓度为c molL﹣1的NaCl溶液,蒸发溶剂,恢复到原来的温度,若物质的量浓度变为2c molL﹣1 , 则质量分数变为(蒸发过程中没有晶体析出,且NaCl溶液的密度大于1g/mL)( )
A.等于2a%
B.大于2a%
C.小于2a%
D.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意解答
(1)某温度下,Kw=10﹣12 . 若保持温度不变,向少量水中加入g的NaOH固体,并加水稀释至1L,才能使溶液中水电离产生的H+、OH﹣的浓度乘积即:c(H+)水c(OH﹣)水=10﹣26 . 若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH﹣)=1010 , 则此时水电离的c(OH﹣)=molL﹣1 .
(2)一定温度下,现有a.盐酸,b.硫酸,c.醋酸 三种酸
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是 . (用a、b、c表示)
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 . (用a、b、c表示)
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 . (用a、b、c表示)
(3)现有两瓶pH=2的盐酸和醋酸溶液,简述如何用最简单的方法区别盐酸和醋酸.(限选试剂:石蕊试液、酚酞试液、pH试纸、蒸馏水).采用的方法为 .
(4)执信中学A学生为了测定某烧碱样品的纯度,准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.用0.200 0molL﹣1的标准盐酸进行滴定,选择甲基橙作指示剂,试根据实验回答下列问题:
①滴定过程中,眼睛应注视;滴定终点时,溶液从色变为色, .
②观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果(填“偏高”、“偏低”或“无影响”);若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果(填“偏高”、“偏低”或“无影响”).
③根据如表数据,通过标准酸滴定,计算待测烧碱溶液的物质的量浓度是 , 烧碱样品的纯度是 . (本小题计算结果保留4位有效数字)
滴定次数 | 待测溶液 | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的 | ||
第①次 | 10.00 | 0.40 | 20.50 |
第②次 | 10.00 | 4.10 | 24.00 |
第③次 | 10.00 | 2.20 | 23.80 |
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化. 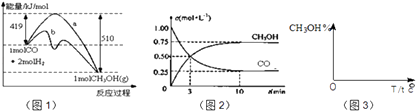
请回答下列问题:
(1)在“图1”中,曲线(填:a或b)表示使用了催化剂;该反应属于反应.
(2)下列说法正确的是 .
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2 , 再次达到平衡时,n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡,v(H2)=;该温度下CO(g)+2H2(g)CH3OH(g)的化学平衡常数值为 . 若保持其它条件不变,将反应体系升温,则该反应化学平衡常数(填“增大”、“减小”或“不变”).
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2 , 且P1<P2).
(5)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ/mol
B、CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(g);△H=﹣192.9kJ/mol
O2(g)=CO2(g)+2H2O(g);△H=﹣192.9kJ/mol
又知H2O(l)=H2O(g)△H=+44kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH,HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7 Ka2=4.7×10﹣11 |
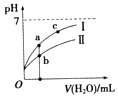
A.如图中的两种酸分别和等浓度的NaOH溶液刚好完全反应,消耗碱的体积相等
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O═2HClO+CO32﹣
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图象中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com