
科目: 来源: 题型:
【题目】银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是。
(2)已知,Ksp=(AgCl)=1.8×10-10 , 若向50mL0.018mol/L的AgNO3溶液中加入50mL0.020mol/L的盐酸,混合后溶液中的Ag+的浓度为 mol/L,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)右图所示原电池正极的反应式为 。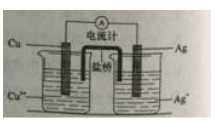
查看答案和解析>>
科目: 来源: 题型:
【题目】在2KMnO4 + 16HCl= 2MnCl2 + 5Cl2↑+ 8H2O + 2KCl的反应中,氧化剂和还原剂的物质的量之比是( )
A. 1﹕8 B. 8﹕1 C. 1﹕5 D. 5﹕1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是测定铝粉(含铜粉等杂质不与酸反应)的纯度的实验装置.
装置为干燥管和锥形瓶,干燥管内装有氯化钙,锥形瓶内所用的硫酸(足量)的物质的量浓度为4molL﹣1 . 不同时间电子天平的读数如下表所示:
实验操作 | t/min | 电子天平的读数/g |
装置+硫酸溶液 | 320.0 | |
装置+硫酸溶液+样品 | 0 | 335.0 |
1 | 334.5 | |
2 | 334.1 | |
3 | 333.8 | |
4 | 333.8 |
①反应中生成气体的质量为 .
②试计算样品中铝的质量分数?(写出计算过程)
③求反应后锥形瓶内硫酸溶液(溶液的体积变化忽略)的物质的量的浓度?(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.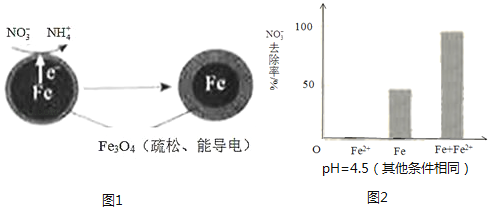
(1)Fe还原水体中NO3﹣的反应原理如图1所示.
①作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
查看答案和解析>>
科目: 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是
A.降低了反应的活化能
B.增大了反应的速率
C.降低了反应的焓变
D.增大了反应的平衡常数
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。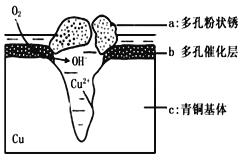
①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 .
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答:
(1)C、G两个装置所盛放的试剂分别是:
CG .
(2)①装置搭好须进行气密性检查,写出操作方法: .
②两处酒精灯应先点燃处(填写A或B),目的是 .
③F中的现象为 , G中出现了一种沉淀,该沉淀的化学式 .
(3)写出在A、E中发生反应的化学方程式为:
A: .
E: .
查看答案和解析>>
科目: 来源: 题型:
【题目】海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl﹣、Br ﹣、I﹣、SO42﹣、Na+、Mg2+、Ca2+等,都是重要资源.开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图:
请根据以上信息回答下列问题:
(1)写出步骤②、⑧分离提纯的方法:
②⑧ .
(2)步骤⑦分离提纯过程中需要选用的玻璃仪器除烧杯外,还需要的仪器是 .
(3)D具有杀菌消毒的作用,请写出反应④的化学方程式 .
(4)初步提纯后的粗盐中含有Ca2+、Mg2+、SO42﹣等杂质,精制时所用的试剂为:
①盐酸 ②氯化钡溶液 ③氢氧化钠溶液 ④碳酸钠溶液,
下列试剂添加顺序合理的是 .
A.②③④①
B.③④②①
C.④③②①
D.③②④①
(5)若用来提取Br2 , 反应⑤所用的氧化剂的来源较合理的是 .
A.从外地购买
B.在当地新建生产厂
C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有性,该方法对比有机溶剂萃取法的优点是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 离子化合物的熔点一定比共价化合物的高
B. 稀有气体形成的晶体属于分子晶体
C. 干冰升华时,分子内共价键会发生断裂
D. 离子晶体的熔点一定比原子晶体高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com