
科目: 来源: 题型:
【题目】根据要求填空:
(1)在短周期主族元素中,氯及其相邻两元素的电负性由大到小的顺序是(用元素符号表示)
(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为;A、B、C三种元素的原子半径由大到小的顺序是 .
电离能/kJmol﹣1 | I1 | I2 | I3 | I4 |
A | 500 | 4600 | 6900 | 9500 |
B | 740 | 1500 | 7700 | 10500 |
C | 580 | 1800 | 2700 | 11600 |
(3)已知过氧化氢分子的空间结构如图所示, 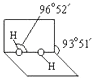 分子中氧原子采取杂化;通常情况下,H2O2与水任意比互溶的主要原因是 .
分子中氧原子采取杂化;通常情况下,H2O2与水任意比互溶的主要原因是 .
(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化: R3+ ![]() R(OH)3
R(OH)3 ![]() [R(OH)4]﹣
[R(OH)4]﹣
①基态R原子的价电子排布式为 .
②[R(OH)4]﹣中存在的化学键是 .
A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4的原子),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】用18molL﹣1浓硫酸配制100mL3.0molL﹣1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③溶解;④冷却;⑤转移、洗涤; ⑥定容、摇匀; ⑦装瓶贴标签.
完成下列问题:
(1)所需浓硫酸的体积是 , 量取浓硫酸所用的量筒的规格是(从下列中选用A.10mL B.25mL C.50mL D.100mL).
(2)第③步实验的操作是 .
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中;
B.容量瓶用蒸馏水洗涤后残留有少量的水;
C.所用过的烧杯、玻璃棒未洗涤;
D.定容时俯视刻度线 .
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6molL﹣1的H2SO4溶液中,乙同学将电极放入6molL﹣1的NaOH溶液中,如图所示.
(1)甲中SO42﹣移向极(填“铝片”或“镁片”).写出甲中正极的电极反应式 .
(2)乙中负极为 , 总反应的离子方程式: . 此反应中氧化剂和还原剂的物质的量之比为 .
(3)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法(填“可靠”或“不可靠”).如不可靠,请你提出另一个判断原电池正负极的可行性实验方案(如可靠,此空可不填).
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧.在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如下表).下列说法中正确的是( )
金属 | 电子流动方向 | 电压 |
A | A→Cu | +0.78 |
B | Cu→B | ﹣2.15 |
C | C→Cu | +1.35 |
D | +0.30 |
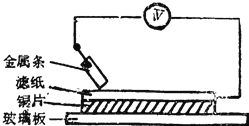
A.金属D与Cu之间电子流动方向为Cu→D
B.A金属可能是最强的还原剂
C.B金属不能从硫酸铜溶液中置换铜
D.B金属可能是最强的还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
(1)已知:N2(g)+2H2(g)=N2H4(l)△H=+50.6kJmol﹣12H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=kJmol﹣1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 .
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 .
(2)采矿废液中的CN﹣ 可用H2O2处理.已知:H2SO4=H++HSO4﹣ HSO4﹣H++SO42﹣用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82﹣ , S2O82﹣水解可以得到H2O2 . 写出阳极上的电极反应式 .
(3)氧化镁处理含NH4+的废水会发生如下反应: MgO+H2OMg(OH)2 Mg(OH)2+2NH4+Mg2++2NH3H2O.
①温度对氮处理率的影响如图所示.在25℃前,升高
温度氮去除率增大的原因是 .
②剩余的氧化镁,不会对废水形成二次污染,理由是 .
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下: ①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL
②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热
③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]
④将吸收液移至锥形瓶中,加入2滴指示剂,用c molL﹣1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL.
则水样中氮的含量是mgL﹣1(用含c、V的表达式表示).(请写出计算过程)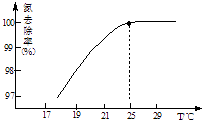
查看答案和解析>>
科目: 来源: 题型:
【题目】现有m g某气体,它由四原子分子构成,它的摩尔质量为M gmol﹣1 , 则:
(1)该气体的物质的量为mol.
(2)该气体中所含的原子总数为个.
(3)该气体在标准状况下的体积为L.
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在如图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )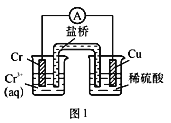
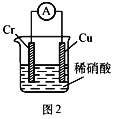
A.图1为原电池装置,Cu电极上产生的是O2
B.图2装置中Cu电极上发生的电极反应式为:Cu﹣2e﹣═Cu2+
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电子均由Cr电极流向Cu电极
查看答案和解析>>
科目: 来源: 题型:
【题目】根据问题填空:
(1)在S2﹣、Fe2+、Fe3+、Mg2+、S、I﹣、H+中,只有氧化性的是 , 只有还原性的是 , 既有氧化性又有还原性的是 .
(2)分析氧化还原反应2P+5Br2+8H2O=2H3PO4+10HBr,用“双线桥法”表示出反应中电子转移的方向和数目为 . 反应中氧化剂与还原剂的物质的量之比为 .
(3)氧化还原反应3S+6KOH=K2S+K2SO3+3H2O中,氧化产物是 , 还原产物是 . 该反应的离子方程式为: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com