
科目: 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se.
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2 , 且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应的化学方程式_.
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O→Se+2SO42﹣+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_ .
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目 .
(4).实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+21O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
B.25℃、101 kPa时,1 mol CO和2 mol CO的燃烧热相等
C.2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<﹣452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烷和乙烯的混合气体200 mL,在催化剂的作用下与氢气发生加成反应,最多消耗氢气100 mL,则原混合气体中乙烷和乙烯的体积比是( )
A. 2∶1B. 3∶1C. 1∶1D. 1∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】不能用来证明非金属性Cl>I的事实是( )
A. ICl中I是+1价,Cl是-1价B. 稳定性:HCl>HI
C. 酸性:HCl<HID. Fe3+可以氧化I-,但不能氧化Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】现有某硫酸铁与硫酸亚铁的混合物,某兴趣小组测定其中铁元素的质量分数,实验按以下步骤进行: 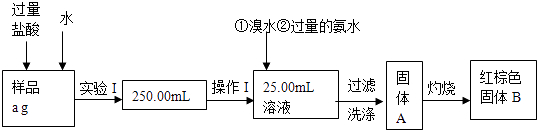
请根据上面流程,回答下列问题
(1)实验I所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须有(填仪器名称)
(2)请写出加入溴水发生反应的离子方程式
(3)称量红棕色固体B的质量为m克,则样品中铁元素的质量分数为 .
(4)有的同学提出还可以采取以下方法来测定: 
①溶解样品改用过量硫酸的原因为 .
②选择的过量还原剂不能用铁,原因为 .
③写出酸性条件下用KMnO4滴定的离子方程式 .
④用滴定管装KMnO4溶液后如尖嘴部位有气泡,滴定后气泡消失,所测得混合中Fe的含量(填:偏大、偏小、无影响)
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型电池,图为电池示意图,据此回答下列问题
: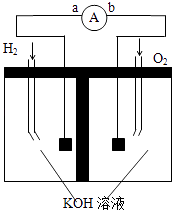
(1)该电池的正极反应式为 .
(2)已知在25℃、101kPa时,C2H6(g)的燃烧热为1559.8kJ/mol,请写出
C2H6(g)燃烧热的热化学方程式为
(3)若将上述装置中的H2改为通入CH4(g)请写出该燃料电池的负极反应式为
.
(4)假设使用的燃料为CH4 , 如用这种电池电镀铜,待镀金属的质量增加12.8g,则至少消耗标准状况下CH4的体积为L.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量一样多
B.需要加热才能发生的反应一定是吸热反应
C.在101kpa时,2gH2完全燃烧,生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣285.8kJ/mol
D.在强酸强碱稀溶液中:H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,若将含1molNaOH的溶液和含0.5molH2SO4的浓硫酸混合,放出的热量大于57.3 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空
(1)常温下将NaOH溶液和一元弱酸HA溶液混合后.
回答下列问题:
①若将PH=3的HA溶液和PH=11的NaOH溶液等体积混合后,溶液的PH值7(填>、<、=)
②若混合后溶液PH值等于7,则混合后溶液中各离子浓度大小次序为 .
(2)已知常温下Ksp[Al(OH)3]=3×10﹣34;Ksp[Fe(OH)3]=4×10﹣38在25℃向浓度均为0.1mol/L的AlCl3和FeCl3混合溶液中逐滴加入氨水,
请写出最先生成沉淀的离子方程式 . 当溶液PH=10时,C(Al3+)=mol/L
(3)1909年化学家哈伯在实验室首次合成了氨.氨的应用较多,据此回答下列问题:合成氨反应的化学方程式为N2(g)+3H2(g)2NH3(g);
①写出该反应的平衡常数表达式:K= .
②在一定条件下的2L密闭容器中进行实验,并测得下列数据
物质 | N2 | H2 | NH3 |
起始(mol) | 2 | 7 | 0 |
10s(mol) | 1.6 | ||
平衡(mol) | 2 |
平衡时,N2的转化率为 .
③在一定温度,一定体积的密闭容器中进行合成氨的实验,下列不可以判断反应达到平衡状态的为 .
A、密度保持不变
B、平均分子量保持不变
C、气体的总物质的量保持不变
D、单位时间内每消耗1molN2的同时生成2mol氨气
④汽车尾气中含有较多的NO2和NO若任意排放可形成光化学烟雾,利用NH3可将其除去,同时得到不会污染空气的物质,试写出NH3与NO2反应的化学化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向一定体积的0.1mol/L的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 ![]() 不变
不变
D.溶液中 ![]() 不变
不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com