
科目: 来源: 题型:
【题目】钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染. 
请回答下列问题:
(1)Fe位于元素周期表中第周期,第族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】向装有碘水的试管中加CCl4振荡,静置后,你观察到的现象是
A. 上层几乎无色,下层紫红色 B. 上层紫红色,下层几乎无色
C. 上层几乎无色,下层橙色 D. 不分层,紫红色
查看答案和解析>>
科目: 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g).若经2s 后测得C的浓度为 0.6molL﹣1 , 现有下列几种说法:①用物质A表示的反应的平均速率为 0.6mol(Ls)﹣1;②用物质B表示的反应的平均速率为 0.15mol(Ls)﹣1;③2s 时物质A的浓度为1.4molL﹣1;④2s 时物质B的转化率为70%.其中正确的是( )
A.①③
B.①④
C.②③
D.③④
查看答案和解析>>
科目: 来源: 题型:
【题目】社会实践活动中,课外兴趣小组对某钢铁厂的铁矿石样品和钢样进行实验、分析、计算,了解了该钢铁厂生产原料、产品的相关信息。下面请你根据他们的实验帮助计算回答:
取该厂的某钢样粉末28.36 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3 g白色沉淀。
(1)计算此钢样粉末中铁和碳的质量之比。
(2)再取三份不同质量的钢样粉末分别加到50 g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:(标准状况下,2 g H2的体积为22.4 L)
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量 / g | 2.836 | 5.672 | 8.508 |
生成气体的体积(标准状况)/ L | 1.12 | 2.24 | 2.80 |
请根据表中数据计算硫酸中H2SO4的质量分数。
(3)若在实验Ⅱ中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少? (用含m的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将酸式滴定管用蒸馏水洗净,用标准盐酸(0.1000mol/L)溶液润洗2遍,注入标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度;将锥形瓶用蒸馏水洗净后,也用该盐酸溶液润洗2遍;从酸式滴定管中放出20.00mL溶液到锥形瓶中.
②将碱式滴定管用蒸馏水洗净,用待测NaOH溶液润洗2遍,调节滴定管尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度.
③向锥形瓶中滴入酚酞作指示剂,进行滴定并用pH计记录pH变化.滴定至指示剂刚好变色,且并不马上恢复原来颜色为止,记录碱式滴定管液面读数.再继续滴定,并记录pH至无明显变化为止.
重复上述取样、滴定工作2次,记录每次实验所用碱溶液体积.
回答下列问题:
(1)图1中有2根滴定管,其中(选填“a”、“b”)是酸式滴定管.
(2)滴定过程中,边滴边摇动锥形瓶,眼睛应观察(选填“a”、“b”).
a.锥形瓶内溶液颜色的变化 b.滴定管内液面的变化
(3)该小组在步骤①中有一个明显的错误操作,由此造成测定结果(选填“偏高”、“偏低”或“无影响”).
(4)图2中该滴定过程的滴定曲线是下列的(选填“a”、“b”).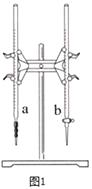

(5)有关数据记录如下:
实验序号 | 盐酸标准液体积(mL) | 所消耗氢氧化钠标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.70 |
2 | 20.00 | 2.00 | 22.00 |
3 | 20.00 | 1.00 | 20.80 |
则该小组计算得到NaOH溶液的物质的量浓度为mol/L.
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出H2O2和稀硫酸的混合溶液与金属铜反应的离子方程式:。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S ![]() 6Cu+SO2↑,该反应的氧化剂是;当生成19.2 g Cu 时,反应中转移的电子为 mol。
6Cu+SO2↑,该反应的氧化剂是;当生成19.2 g Cu 时,反应中转移的电子为 mol。
(3)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。称取a g试样配成 100 mL 溶液,取出25.00 mL溶液,向其中滴加 KI 溶液后有白色沉淀生成(发生的反应为2Cu2++4I-=2CuI↓+I2);继续滴加 KI 溶液至沉淀不再产生,反应生成的 I2 与V mL c mol·L-1Na2S2O3溶液恰好完全反应(发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6)。则试样中CuSO4·5H2O的质量分数为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com