
科目: 来源: 题型:
【题目】2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( ) 
A.分子式为C15H22O5
B.能够发生水解反应
C.每个分子中含有4个六元环
D.青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:aA(g)+bB(g) cC(g)+dD(g);根据图回答:
①压强 P1P2;(a+b)(c+d)(填“>”或“<”下同).
②温度t1℃t2℃;△H0.
③保持体积和温度不变,通入He,平衡会移动(填“正向”、“逆向”或“不”).
查看答案和解析>>
科目: 来源: 题型:
【题目】铁有δ、γ、α三种同素异形体,如下图所示,三种晶体在不同温度下能发生转化。下列说法不正确的是( )
A.δFe晶体中与每个铁原子等距离且最近的铁原子有8个
B.αFe晶体中与每个铁原子等距离且最近的铁原子有6个
C.若δFe晶胞边长为acm,αFe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。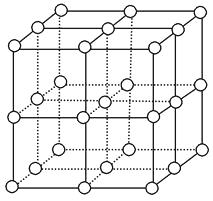
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有个。
(3)在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于 , 即(填计算式);Na+的个数等于 , 即(填计算式)。
(4)设NaCl的摩尔质量为Mrg·mol-1 , 食盐晶体的密度为ρg·cm-3 , 阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方法能达到实验目的是( )
A.用分液漏斗从食醋中分离出乙酸
B.用焰色反应鉴别Na2SO4和Na2CO3
C.用NaOH溶液除去Cl2中含有的少量HCl
D.用KSCN溶液检验FeCl3溶液 中是否含有Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】核内中子数为N的R2+的离子,质量数为A,则n克它的氧化物中所含质子的物质的量为( )
A.![]() (A-N+8)
(A-N+8)
B.![]() (A-N+10)
(A-N+10)
C.(A-N+2)
D.![]() (A-N+6)
(A-N+6)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,且原子序数依次增大,其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)比E核外电子数少5的元素的原子核外电子排布式是,A、B、C、D的第一电离能由小到大的顺序为。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是。
(3)A的氢化物属于(填“极性”或“非极性”)分子,D的低价氧化物分子的空间构型是。
(4)A、E形成的某种化合物的晶胞结构如图所示,则其化学式为(每个球均表示1个原子)。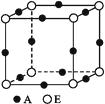
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com