
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A. 标准状况下,22.4LH2O中含有NA个水分子
B. 1molCl2与足量的铁发生反应,转移的电子总数为3NA
C. 常温常压下,48gO3和O2混合气体含有的氧原子数为3NA
D. 同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
查看答案和解析>>
科目: 来源: 题型:
【题目】已知C﹣C单键可以绕键轴旋转,某结构简式可表示为 ![]() 烃,下列说法中正确的是( )
烃,下列说法中正确的是( )
A.分子中至少有9个碳原子处于同一平面上
B.该烃的一氯代物只有一种
C.分子中至少有10个碳原子处于同一平面上
D.该烃是苯的同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表述中不正确的是
A. 漂白粉的有效成分是次氯酸钙
B. 碱性氧化物都是金属氧化物,酸性氧化物不一定是非金属氧化物
C. 碳酸、纯碱、石灰石、生石灰是按酸、碱、盐、氧化物分类顺序排列的
D. 依照阿伏加德罗定律,同温同压下两种气体的摩尔质量之比等于密度之比
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的a L氯化氢气体溶于100 g水中,得到盐酸的密度为b g·mL-1,则该盐酸的物质的量浓度是______________________。
(2)向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为__________________。
(3)FeCl3溶液可以用来净水,其净水的原理为____________________________________(用离子方程式表示)。用100 mL 2 mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________(填“大于”“等于”或“小于”)0.2NA。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质不属于同系物的是( ) ①CH2﹣CH﹣COOH和C17H33COOH
② 
③正丁烷和2,2﹣二甲基丙烷
④CH3CH2CHO和 ![]()
A.①③
B.①④
C.②③
D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料﹣﹣光导纤维,C与烧碱反应生成含A元素的化合物D.
(1)与A同族但相对原子质量比A小的元素B的原子结构示意图为 .
(2)C与氢氟酸反应的化学方程式是 .
(3)将C与纯碱混合高温熔融时反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,生成了含A的化合物F.
①生成D和F的化学方程式分别为、 .
②要将纯碱高温熔化,下列坩埚中可选用的是 .
A.普通玻璃坩埚B.石英玻璃坩埚C.氧化铝坩埚D.铁坩埚.
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用下列方法测定某水样中O2的含量。
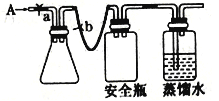
(1)实验原理
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为_____________________________。
②在酸性条件下,再用I-将生成的MnO(OH)2,还原为Mn2+,反应的离子方程式为_____________________________。然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为I2+2 Na2S2O3=2Na1+Na2S4O6。
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是___________________________;
②用注射器抽取某水样20. 00mL从A处注入锥形瓶;
③再分别从A处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸;
⑥重复④的操作;
⑦取下锥形瓶,向其中加入23滴_______作指示剂;
⑧用0.005 mol L -1 Na2S2O3溶液滴定至终点。滴定终点的现象是___________________________。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________ mg L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将_________ (填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一小段镁带投入盛有稀盐酸的试管中,发生剧烈反应.一段时间后,用手触摸试管外壁感觉烫手.这个实验事实说明该反应( )
A.为放热反应
B.为吸热反应
C.反应过程中热能转化为化学能
D.反应物的总能量低于生成物的总能量
查看答案和解析>>
科目: 来源: 题型:
【题目】奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量)通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大________(填字母)。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
(2)若称取样品的质量为1.5 g,共配制100 mL的溶液,取其中的20 mL,经过一系列处理后,使N转变为硼酸铵后用0.1 mol·L-1盐酸滴定,其用去盐酸的体积为23.00 mL,则该样品中N的含量为________(保留两位小数)。[已知:滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com