
科目: 来源: 题型:
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: SO2(g)+NH3H2O(aq)=NH4HSO3(aq)△H1=a kJmol﹣1
NH3H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=c kJmol﹣1
(1)反应2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 △H=kJmol﹣1 .
(2)空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是 .
(3)以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用.反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数 K= .
[已知Ksp(CaCO3)=2.9×10﹣9 , Ksp(CaSO4)=9.1×10﹣6]
(4)(NH4)2SO4在工农业生产中有多种用途. ①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气.该反应的化学方程式为 . 
②研究硫酸铵的分解机理有利于对磷石膏的开发.在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示.写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目: .
③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路: . 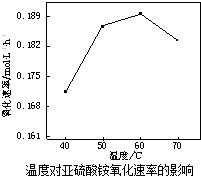
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质转化关系如下图,已知A是一种常见金属,F是一种红褐色沉淀。回答下列问题。
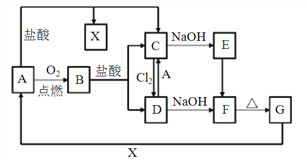
(1)A的化学式为_______;
(2)实验室保存C溶液时需加少量固体A,目的是_____________________。B与盐酸反应的离子方程式为_____________________________。
(3)检验C溶液中阳离子常用的方法是______________________________。
(4)E的浊液在空气中会变质生成F,对应现象为_______________________________ 。
(5)向C中加入Na2O2也可实现C向D和F的转化,Na2O2完全被还原。反应的离子方程式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面均是正丁烷与氧气反应的热化学方程式(25℃、101kPa):
①C4H10(g)+ ![]() O2(g)═4CO2(g)+5H2O(l);△H=﹣2 878kJmol﹣1
O2(g)═4CO2(g)+5H2O(l);△H=﹣2 878kJmol﹣1
②C4H10(g)+ ![]() O2(g)═4CO2(g)+5H2O(g);△H=﹣2 658kJmol﹣1
O2(g)═4CO2(g)+5H2O(g);△H=﹣2 658kJmol﹣1
③C4H10(g)+ ![]() O2(g)═4CO(g)+5H2O(l);△H=﹣1 746kJmol﹣1
O2(g)═4CO(g)+5H2O(l);△H=﹣1 746kJmol﹣1
④C4H10(g)+ ![]() O2(g)═4CO(g)+5H2O(g);△H=﹣1 526kJmol﹣1
O2(g)═4CO(g)+5H2O(g);△H=﹣1 526kJmol﹣1
由此判断,正丁烷的燃烧热为( )
A.﹣2878 kJ/mol
B.﹣2 658kJ/mol
C.﹣1746 kJ/mol
D.﹣1526 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】1mol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol
B.C(s)+ ![]() O2(g)=CO(g)△H=﹣393.5 kJ/mol
O2(g)=CO(g)△H=﹣393.5 kJ/mol
C.C+O2=CO2△H=﹣393.5 kJ/mol
D.C(s)+O2(g)=CO2(g)△H=﹣393.5 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】G是一种新型香料的主要成分之一,其结构中含有三个六元环.G的合成路线如图(部分产物和部分反应条件略去): 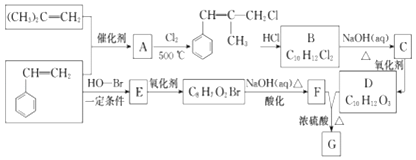
己知:①RCH=CH2+CH2=CHR﹣﹣﹣﹣CH2═CH2+RCH═CHR;
②B的核磁共振氢谱图显示分子中有6 种不同环境的氢原子;
③D和F互为同系物.
(1)(CH3)2C=CH2 , 分子中在同一平面内的原子数最多为 . D分子中含有的含氧官能团名称是 .
(2)A→R反应过程中涉及的反应类型依次为、 .
(3)E的结构简式为 . G的结构简式为 .
(4)B→C的化学方程式为 .
(5)写出同时满足下列条件的F的一种同分异构体的结构简式 . ①能与FeCl3溶液发生显色反应;
②苯环上有两个取代基且能发生水解反应;
③其核磁共振氢谱图中有4 组峰.
(6)模仿由苯乙烯合成F的方法,写出由丙烯制取  的合成路线: .
的合成路线: .
查看答案和解析>>
科目: 来源: 题型:
【题目】科学研究发现,三种金属或两种金属可以组成准晶体。某准晶体样品M可能由铁、铜和铝中的三种或两种组成。
【实验目的】探究 ________________ 。
【提出假设】猜想1:M的成分是铁和铜;
猜想2:M的成分是铁和铝;
猜想3:M的成分是______;
猜想4:M的成分是铁、铜和铝
【设计实验】取两份质量均为m g的M样品,按图1和图2装置分别进行实验:实验前后条件都是常温、常压,待样品M充分反应后,按图1、图2实验方案完成实验并测得气体体积分别为V1 L和V2 L(所测定的气体体积已折合成标准状况)。
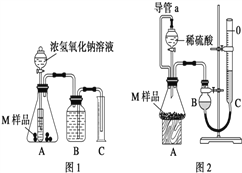
(1)完成实验目的和猜想填空内容。
(2)若该实验需要0.50mol/LNaOH溶液 180mL,按中学常用规格仪器配制时应称量____g NaOH(用托盘天平),若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度_____(填“偏大”、“偏小”或“无影响”)
(3)进行实验1前,B瓶中的水没有装满,使测得的气体体积 _______(填“偏大”、“偏小”或“无影响”),实验2中的导管a的作用为_____________并能防止因加入液体而排出锥形瓶内部分空气,导致测定的气体体积偏大。
(4)若V1≠0,则推测上述猜想 ________(填“1”、“2”、“3”或“4”)一定不成立,若猜想3成立,则V1 ________V2(填“>”、“<”或“=”)。
(5)若V1<V2≠0 ,则M样品中铁的质量为____________g(用含V1和V2式子表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.
(1)冶炼铜的反应为:8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号).若反应中生成了标况下22.4L气体,转移的电子数目为________。
(2)上述冶炼过程产生大量酸性氧化物SO2,为大气污染物之一。下列处理方案中合理的是________(填代号).
a.高空排放 b.用浓硫酸氧化吸收制硫酸
c.用NaOH溶液吸收制Na2SO3 d.用氨水吸收制氮肥铵盐
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O![]() +2I-=2SO
+2I-=2SO![]() +I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)。
+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
据以上信息回答下列问题:
a.除去Al3+的离子方程式是________.
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水 所选试剂为________.证明炉渣中含有FeO的实验现象为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 某试样焰色反应呈黄色,则试样中肯定不含有K+
B. 过滤操作时,为了加快过滤可以用玻璃棒搅拌漏斗的液体
C. 蒸馏装置中,温度计水银球的位置应该在蒸馏烧瓶的支管口附近
D. 粗盐的提纯实验中,滤液在坩埚中加热蒸发结晶
查看答案和解析>>
科目: 来源: 题型:
【题目】苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变化为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有( )
A.氧化性B.还原性C.碱性D.酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. 沸点:H2O>HFB. NCl3、SiCl4分子中每个原子最外层均满足8电子结构
C. 热稳定性:HF>H2OD. 仅由N、H、O三种元素形成的化合物中不可能含离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com