
科目: 来源: 题型:
【题目】下列说法不正确的是 ( )
A.工业制取硫酸过程中生成的SO2可循环利用
B.钢铁因含杂质而容易生锈,所以合金一定不耐腐蚀
C.沙子、石英、水晶、硅藻土都是天然存在的二氧化硅
D.在医疗上硫酸亚铁可用作生产防治缺铁性贫血的药剂
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )

A. 试剂X氢氧化钠溶液
B. 反应①、过滤后所得沉淀为红褐色Fe2O3
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体,再在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):
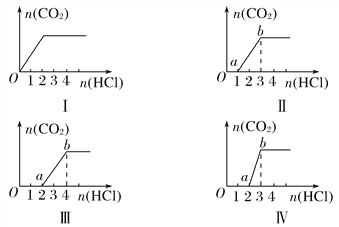
则下列分析都正确的组合是( )
①Ⅰ图对应溶液中的溶质为NaHCO3
②Ⅱ图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1∶1
③Ⅲ图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1∶1
④Ⅳ图对应溶液中的溶质为Na2CO3
A. ①② B. ①③
C. ②④ D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( ) 
A.用装置甲制取氯气
B.用装置乙除去氯气中混有的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl24H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氮的说法正确的是( )
A.N2分子的结构较稳定,因而氮气不能支持任何物质燃烧
B.23 g NO2和N2O4混合气含有0.5NA个氮原子(NA表示阿伏加德罗常数)
C.NO可用向上排空气法或者排水法收集
D.浓硝酸保存在棕色瓶内是因为硝酸易挥发
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1: 己知:A中放有浓硫酸;B中放有乙醇、无水碳酸钠;D中放有饱和碳酸钠溶液.
有关有机物的沸点.
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用:催化剂和;反应中加入过量的乙醇,目的是 .
(2)仪器C的名称是 , 其作用有冷凝乙酸乙酯和 , 若反应前向D中加入几滴酚酞,溶液呈红色.实验完毕后,将烧杯D中的溶液充分振荡、静止,现象为 .
(3)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式: .
(4)现拟分离乙酸乙酯(含少量乙醇和乙酸)粗产品,如图2是分离操作步骤流程图: 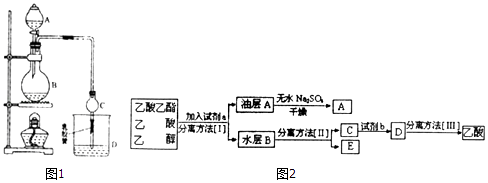
则试剂a是: , 试剂b是: . 分离方法I是 , 分离方法II是
(5)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都先加NaOH溶液中和酯中过量的酸,然后用蒸馏水将酯分离出来.甲、乙两人实验结果如下:甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为甲、乙的实验没有成功. 试解答下列问题:
①甲实验失败的原因是: .
②乙实验失败的原因是: .
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示.钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价. 
已知:TiOSO4遇水会水解.
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为 .
(2)步骤③中,实现混合物的分离是利用物质的(填字母序号). a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是(填操作名称).
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理: .
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4 , 易溶于水),该反应的离子方程式为 .
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2﹣CaO作电解质,利用如下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛. 
①写出阳极所发生反应的电极反应式: .
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释) .
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法:2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法II和方法III制取Cu2O而很少用方法I,其原因是 .
(2)己知:2Cu(s)+ ![]() O2(g)=Cu2O(s)△H=﹣akJmol﹣1C(s)+
O2(g)=Cu2O(s)△H=﹣akJmol﹣1C(s)+ ![]() O2(g)=CO(s)△H=﹣bkJmol﹣1
O2(g)=CO(s)△H=﹣bkJmol﹣1
Cu(s)+ ![]() O2(g)=CuO(s)△H=﹣ckJmol﹣1
O2(g)=CuO(s)△H=﹣ckJmol﹣1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=kJmol﹣1 .
(3)方法II采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 .
(4)方法III为加热条件下用液态拼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2 . 该制法的化学方程式为 .
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: 2H2O(g) ![]() 2H2(g)+O2(g)△H>0
2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示.
序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是(填字母代号).
A.实验温度:T1<T2
B.实验①前20min的平均反应速率v(O2)=7×10﹣5mol/(Lmin)
C.实验②比实验①所用的催化剂效率高
(6)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀.若已知Ksp(AgCl)=1.8×10﹣10 , 则此时溶液中的c(Ag+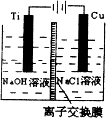
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 酸性溶液中:Cl-、Mg2+、Fe3+、SCN-
B. 1.0 mol·L-1的NaNO3溶液中:Fe2+、K+、H+、SO42﹣
C. 在强碱性环境中:AlO![]() 、CO
、CO![]() 、Na+、K+
、Na+、K+
D. 0.1 mol·L-1明矾溶液中:NH![]() 、AlO
、AlO![]() 、HCO
、HCO![]() 、Na+
、Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】物质世界丰富多彩,可以分类认识和研究。下列依据不同角度对物质分类正确的是
A.金属单质在化学反应中化合价升高,是氧化剂
B.Na2O、CaO与酸反应只生成盐和水,均属于碱性氧化物
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.盐酸和熔融的烧碱均能导电,都是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com