
科目: 来源: 题型:
【题目】下列有关阿伏伽德罗常数(NA)的说法错误的是
A. 22.4LO2所含的原子数目为NA B. 0.5molH2O含有的原子数目为1.5NA
C. 1molH2O含有的H2O分子数目为NA D. 0.5molCl2中含有0.5NA 个氯原子
查看答案和解析>>
科目: 来源: 题型:
【题目】固定容积为2L的密闭容器中发生反应xA(g)+yB(g)zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( ) 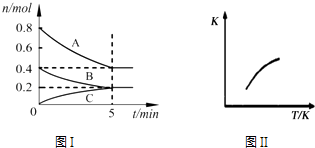
A.该反应可表示为:2A(g)+B(g)C(g)△H<0
B.t℃时该反应的平衡常数K=6.25
C.当容器中气体密度不再变化时,该反应达到平衡状态
D.t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是( ) 
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.用装置①进行电镀,镀件接在b极上
C.装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+
D.装置③中的铁钉几乎没被腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A.化学试剂一经从存储容器中取出,剩余部分均不得再放回原容器,以免污染试剂
B.萃取振荡时要及时打开分液漏斗上口玻璃塞放气
C.检验干燥的气体时,试纸要湿润
D.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ag2SO4的Ksp 为2.0×10-5,将适量Ag2SO4固体溶于水中配成100 mL饱和溶液,该过程中Ag+和SO42-浓度随时间变化关系如图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )
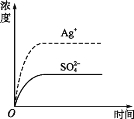

查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,Ksp(Ag2CrO4)=1.1×10-12。下列说法中正确的是( )
A.由于Ksp(AgCl)>Ksp(AgI),所以AgI可以转化为AgCl
B.向Ag2CrO4溶液中加入固体K2CrO4,溶解平衡逆向移动,所以Ag2CrO4的Ksp减小
C.由于Ksp(Ag2CrO4)<Ksp(AgCl),所以沉淀AgCl容易转化为沉淀Ag2CrO4
D.常温下,AgCl饱和溶液中加入NaI,若要使溶液中开始转化为AgI,则NaI的浓度必不低于0.75×10-11 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下CH4、HCl、H2S、NH3均为气体.在标准状况下分别有①13.44L CH4②1molHCl分子 ③27.2gH2S ④2.408×1023个NH3分子,下列说法正确的是( )
A.体积:②>③>④>①
B.密度:②>③>①>④
C.质量:②>③>④>①
D.H原子个数:①>③>④>②
查看答案和解析>>
科目: 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度(假设Zn2+浓度为10-5 mol·L-1时,Zn2+已沉淀完全)。下列说法不正确的是( )

A.往ZnCl2溶液中加入足量氢氧化钠溶液,离子方程式为Zn2++4OH-![]() [Zn(OH)4]2-
[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17
C.某废液中含Zn2+,沉淀Zn2+可以控制溶液pH的范围是8~12
D.向1 L 1 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH 2 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】依照阿伏伽德罗定律,下列叙述正确的是 ( )
A. 同温同压下两种气体的体积之比等于摩尔质量之比
B. 同温同压下两种气体的物质的量之比等于密度之比
C. 同温同压下两种气体的摩尔质量之比等于密度之比
D. 同温同体积下两种气体的物质的量之比等于压强的反比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com