
科目: 来源: 题型:
【题目】25℃、101kPa下:
①2Na(s)+ ![]() O2(g)═Na2O(s)△H1=﹣414kJ/mol;
O2(g)═Na2O(s)△H1=﹣414kJ/mol;
②2Na(s)+O2(g)═Na2O2(s)△H2=﹣511kJ/mol.
下列说法正确的是( )
A.①和②生成等物质的量的产物,转移的电子数相同
B.Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
C.25℃、101 kPa下,Na2O2(s)+2Na(s)═2Na2O(s)△H=+317 kJ/mol
D.①和②产物中的阴阳离子个数比均为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe3O4、Al2O3、CuO三者混合物的综合利用流程如图: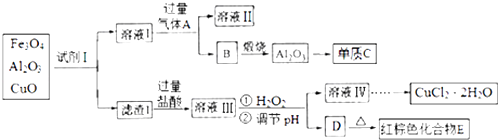
据此回答下列问题:
(1)向溶液Ⅰ中通入过量气体A可以得到两种治疗胃酸过多的药物,该反应的离子方程式是: . 将溶液Ⅱ小心蒸干可得俗名为的酸式盐.
(2)若单质C与化合物E之间的反应为置换反应,则要证明二者反应后的混合物中含有单质C所需的试剂为(填代号).
a.稀硫酸 b.氢氧化钠溶液 c.浓硝酸 d.盐酸
根据上述选择,能说明混合物中含有单质C的离子方程式:
(3)向溶液Ⅲ中加入H2O2后反应的离子方程式是: .
(4)由下列物质冶炼相应金属时与上述流程中单质C的冶炼方法相同的是 .
a.Fe2O3 b.NaCl c.Cu2S d.Ag2O
(5)简述由溶液Ⅳ获得CuCl22H2O的方法
(6)取溶液Ⅲ少许置于试管中,滴加酸性高锰酸钾溶液,溶液紫色褪去,(填“能”或“不能”)说明溶液I中含有Fe2+ , 理由是(用简要文字说明).
查看答案和解析>>
科目: 来源: 题型:
【题目】生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN﹣氧化的反应).
【相关资料】
①氰化物主要是以CN﹣和[Fe(CN)6]3﹣两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3﹣较CN﹣难被双氧水氧化,且pH越大,[Fe(CN)6]3﹣越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
实验 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | 7 | 60 | 10 |
(2)实验测得含氰废水中的总氰浓度(以CN﹣表示)随时间变化关系如图所示.
实验①中20~60min时间段反应速率:υ(CN﹣)= molL﹣1min﹣1 .
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是 (填一点即可).在偏碱性条件下,含氰废水中的CN﹣最终被双氧水氧化为HCO3﹣ , 同时放出NH3 , 试写出该反应的离子方程式: .
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN﹣浓度可用离子色谱仪测定)
实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学实验的说法正确的是
A.乙醇和乙酸乙酯的混合物可以通过蒸馏装置加以分离
B.为配制Fe(NO3)2溶液需加少许稀HNO3抑制Fe2+水解
C.可用浓溴水彻底吸收浓H2SO4和蔗糖反应产生的气体
D.由于NH3显碱性故可以做成喷泉实验
查看答案和解析>>
科目: 来源: 题型:
【题目】将30mL 0.5 mol/L NaOH溶液加水稀释到500 mL,稀释后溶液的浓度为( )
A. 0.1 mol/LB. 0.3 mol/LC. 0.05 mol/LD. 0.03 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
装置 | 现象 | 结论及解释 |
| ①A试管中黑色沉淀逐渐溶解 | a.现象②说明褐色沉淀具有 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2 , 过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为
查看答案和解析>>
科目: 来源: 题型:
【题目】通过对近代化学发展的里程碑的学习,我们体会到化学是在原子、分子水平上研究物质的自然科学,请把重大成果与发现者连起来_____。
①道尔顿 a.提出化学元素的概念
②波义耳 b.建立氧化学说
③拉瓦锡 c.提出原子论
④门捷列夫 d.发现元素周期律
⑤阿伏加德罗 e.分子学说
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期常见元素形成的物质A、B、C、D、E、F的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同,也可能不同).请回答下列问题: 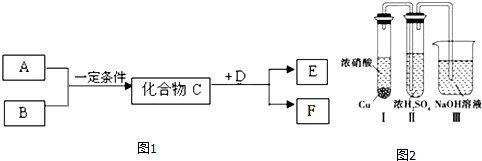
(1)若C是一种淡黄色离子化合物,B、E为同种气体,F是一种水溶液显碱性的正盐,写出C与D反应的化学方程式
(2)若A、B反应生成C是人工工业固氮的反应原理,D是双原子分子气态单质,其密度为3.17g/L(标准标况下),F在常温下是一种无色晶体,且受热易分解,写出实验室检验无机盐F中阳离子的方法: .
(3)若C是一种气体,D在常温下是一种无色无味的液体,E为无色气体,F是一种强酸.
①C与D反应的化学方程式 .
②有人认为“浓H2SO4可以干燥气体C”.甲同学为了验证该观点是否正确,用图2装置进行实验.实验过程中,在小铜块和浓硝酸刚开始反应的一段时间内浓H2SO4中未发现有气体逸出,且浓硫酸颜色加深,则你得出的结论是 .
③甲同学设计的实验中,装置Ⅲ的主要作用 .
④甲同学在实验过程中装置Ⅲ内发生一氧化还原反应生成两种钠盐,其中一种是外观与食盐很相似的有毒物质亚硝酸盐,写出该反应的方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】在与外界隔离的体系中,自发过程将导致体系的熵 , (填“增大”、“减小”、“不变”);对于同一种物质,时熵值最大.(填“固态”、“液态”、“气态”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com