
科目: 来源: 题型:
【题目】在15℃下将氨气通入一盛水的玻璃球内,至氨气不再溶解为止。经称量得知玻璃球内的饱和溶液质量为3.400g,然后将玻璃球浸入体积为50.00mL浓度为0.5000mol/L的硫酸溶液中,将球击破。充分反应后溶液中剩余的酸还能与10.00mL 1.000mol/L的NaOH溶液恰好完全反应生成正盐。该氨水中的溶质全部以NH3计,则:
(1)饱和溶液中NH3的物质的量为____________________。
(2)饱和溶液中NH3的质量分数为__________。
(3)测得所得饱和氨水的密度为0.918g/cm3,则饱和溶液中NH3的物质的量浓度为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】精确配制一定物质的量浓度的溶液通常有两种方法:直接法和标定法。直接法是准确称量一定的物质,制成一定体积的溶液;标定法则是先粗略配制一定浓度的溶液,再用已知浓度的溶液标定其浓度。对于在空气中稳定,且试剂纯度高,组成和化学式相符的物质,通常采用直接法;而对于不易提纯、组成不定或容易分解的物质,则采用标定法。
(一)用无水碳酸钠固体配制250mL 0.1000mol/L碳酸钠溶液。
(1)计算需要碳酸钠固体的质量为ag,a=__________。
(2)用分析天平准备称量质量为ag的无水碳酸钠固体,为配制所需的碳酸钠溶液还需要的玻璃仪器有:________________________________________。
(二)用浓盐酸配制250mL约0.2mol/L盐酸并标定其精确浓度。
(3)计算需要浓盐酸(质量分数为36.5%,密度为1.2g/cm3)的体积为bmL,则b=__________(计算结果保留到小数点后一位)。
(4)用量筒量取bmL浓盐酸,缓慢加入盛有(250-b)mL水的烧杯中,用玻璃棒搅拌,即得所需溶液。
(5)用酸式滴定管(注:酸式滴定管是一种可较为精确量取液体体积的量器)量取25.00mL所配盐酸溶液,放入锥形瓶,逐滴加入上述碳酸钠溶液至正好完全反应生成NaCl溶液,消耗碳酸钠溶液的体积为25.00mL,则所配制盐酸的浓度为__________。
(6)为何不用直接法配制盐酸溶液?答:________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制浓硫酸、浓硝酸的混合物与苯反应制取硝基苯。得到粗产品后,要选用如下几步操作对粗产品进行精制:
①蒸馏
②水洗
③用干燥剂进行干燥
④用10%的NaOH溶液洗涤。
正确的操作步骤是( )
A. ①②③④②B. ②④②③①C. ④②③①②D. ③④①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意填空
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)c(OH﹣)=1×10﹣20的溶液,其pH为 , 此时水的电离受到
(2)在某温度下,H2O的离子积常数为1×10﹣13 mol2L﹣2 , 则该温度下:100mL 0.1molL﹣1H2SO4溶液与100mL 0.4molL﹣1的KOH溶液混合后,pH= .
(3)已知一溶液有4种离子:X+、Y﹣、H+、OH﹣ , 下列分析结果肯定错误的是
A.c(Y﹣)>c(X+)>c(H+)>c(OH﹣)
B.c(X+)>c(Y﹣)>c(OH﹣)>c(H+)
C.c(H+)>c(Y﹣)>c(X+)>c(OH﹣)
D.c(OH﹣)>c(X+)>c(H+)>c(Y﹣)
(4)在25℃下,将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).则溶液显(填“酸”“碱”或“中”)性;用含a的代数式表示NH3H2O的电离常数Kb= .
(5)水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值:
HClO:Ka=3×10﹣8 H2CO3:Ka1=4.3×10﹣7 Ka2=5.6×10﹣11;84消毒液中通入少量的CO2 , 该反应的化学方程式为
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸二甲酯(DMC)是一种低毒性的绿色化学品,可用于代替高毒性的光气(COCl2)作羰基化试剂.DMC的合成路线如图.完成下列填空.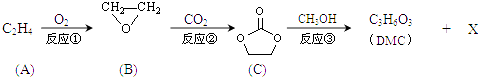
已知:RCO﹣OR1+R2O﹣H→RCO﹣OR2+R1O﹣H (称酯交换反应)
(1)写出反应类型:反应①;
(2)写出结构简式:X;
(3)已知物质Y与DMC互为同分异构体,Y的水溶液呈酸性,在一定条件下2molY能生成1mol分子中含六元环结构的有机物Z,则Z的结构简式为;
(4)DMC与双酚( 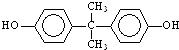 )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式: .
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】关于原子核外电子排布的下列叙述不正确的是
A.核外电子总是尽可能排布在能量最低的电子层
B.每一个电子层最多可容纳的电子数为2n2
C.某原子的核外最外层最多可容纳8个电子
D.当M层为次外层时,最多可容纳18个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )
A. Na2CO3是碳酸盐 B. Na2CO3是盐
C. Na2CO3是钠盐 D. Na2CO3是碱
查看答案和解析>>
科目: 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、 NH4+、 Mg2+、 Ba2+、 Cl-、 SO42—、 CO32—。
将该混合物溶于水后得澄清溶液。 现取3份100 mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
A | 加 AgNO3溶液 | 有白色沉淀生成 |
B | 加足量 NaOH 溶液并加热 | 收集到气体 1.12 L(标准状况下) |
C | 加足量 BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥称量 | 第一次称量沉淀质量为6.63 g,第二次称量沉淀质量为4.66 g |
试回答下列问题:
(1)根据实验A判断 Cl-是否存在_____(填“一定存在” 、 “一定不存在” 或“不能确定”)。
(2)该混合物中一定不存在的离子是_____。
(3)写出实验B发生反应的离子方程式_____________。
(4)溶液中一定存在的阴离子及其物质的量浓度为(可不填满):
阴离子符号 | 物质的量浓度(mol·L-1) |
(5)混合物中是否存在 K+?_____(填“存在” 或“不存在” )
①如果存在, c(K+) _____mol/L(如果选择“不存在” ,此问不必做答)
②如果不存在,判断的理由是_____。(如果选择“存在” ,此问不必做答)
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库。下图是从海水中提取食盐和溴的主要流程。

(1)粗盐除含 NaCl 外,还含有少量 MgCl2、 CaCl2、 Na2SO4以及泥沙等杂质。以下是粗盐提纯的
操作流程。

提供的试剂:
Na2CO3溶液、 K2CO3溶液、 NaOH 溶液、 BaCl2溶液、 Ba(NO3)2溶液、饱和 NaCl 溶液。
①除去溶液 I 中的 MgCl2、 CaCl2、 Na2SO4,从提供的试剂中选出 a 所代表的试剂,按滴加顺序依次为: 过量的NaOH 溶液、_______、_______;
②如何证明操作①中 NaOH 溶液已经过量?_______。
③蒸发过程所用的主要仪器有:铁架台、酒精灯、_______;
(2)某同学在实验室中用四氯化碳萃取较高浓度的溴水中的溴,经振荡并在铁架台上静置分层后,
①分离出四氯化碳层的操作是:_______。
②分离溴的四氯化碳溶液的操作方法是:_______。
(3)工业上将较高浓度的溴水经进一步处理得到工业溴。某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料, Br2的沸点为 59℃,微溶于水,有毒性和强腐蚀性。水的沸点为 100℃。他们参观生产过程后,设计了如下装置简图:

①图中仪器 B 的名称:_______。
②用热水浴加热的优点是:_______。
③实验装置气密性良好,要达到提纯溴的目的,收集溴时温度计应控制的温度为:_______℃。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com