
科目: 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸. 反应原理: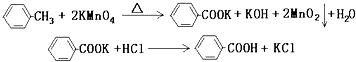
实验方法:一定量的甲苯和KMnO4溶液在 100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.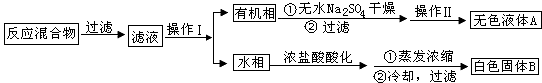
已知:苯甲酸分子量122,熔点 122.4℃,在 25℃和 95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为 , 操作Ⅱ为 .
(2)无色液体A是
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔. 该同学推测白色固体B是苯甲酸与少量KCl的混合物.
①欲从混合物中提纯苯甲酸,应进行的操作是 , 具体过程包括:加入适量蒸馏水→→→过滤、洗涤、干燥.
②在①提纯过程中,应用对晶体进行洗涤,洗涤的目的是 , 如何检验洗涤已经完全: .
③欲检验经过①提纯后的固体是否纯净,可以采用的实验方法是 , 如果固体纯净,对应的现象是
(4)将提纯后的苯甲酸进行核磁共振氢谱分析,可以得到种峰,峰面积之比为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】2014年诺贝尔物理学奖得主的贡献是发明了一种高效而环保的光源﹣﹣蓝色发光二极管(LED).某同学对此非常感兴趣,请你帮助某同学完成资料收集的工作.
(1)LED研究起始于对碳化硅晶体的研究.1907年,英国科学家Henry Joseph Round发现在施加电流时能够在碳化硅晶体中发现发光现象. (i)碳化硅晶体属于晶体.
(ii)碳化硅的晶胞结构与金刚石的相似,在碳化硅晶体中,碳原子所连接最小的环由个碳原子和个硅原子组成,每个碳原子连接个这样的环.
(iii)碳化硅中,碳原子采取杂化方式,与周围的硅原子形成的键角为 .
(iv)请结合原子结构的知识解释发光的原因: .
(2)准现代LED.1962年,GE公司使用磷砷化镓(GaAsxP1﹣x)材料制成了红色发光二极管.这是第一颗可见光LED,被视为现代LED之祖.随后又出现了绿色LED磷化镓(GaP)和黄色LED碳化硅,使光谱拓展到橙光、黄光和绿光. (i)镓在元素周期表的位置是 , 其基态原子的价电子排布式为 .
(ii)人们发现在磷砷化镓或磷化镓中掺杂氮(利用氮代替磷或砷的位置),可以提高其发光效率.其原因不可能为(多选).
A、氮的半径比磷和砷的半径小,用氮代替部分磷或砷的位置不会影响晶体的构型.
B、N的第一电离能大于磷和砷,容易失去电子,发生电子跃迁.
C、N的电负性大,掺杂后得到的位置中存在氢键.
D、N是与砷、磷具有相同价电子结构的杂质,但对电子束缚能力较磷和砷强,造成等电子陷阱.
(3)1993年,中村修二等人开发出首个明亮蓝光的氮化镓LED.凭借此成就,他获得了2014年诺贝尔物理学奖. 为测试氮化镓绿色LED光强与电流的关系,得到如图,从图中你能得到规律(写一条即可)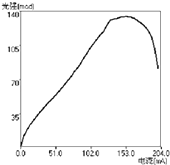
查看答案和解析>>
科目: 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为____________。
(2)A与溴的四氯化碳溶液反应的化学方程式为____________,反应类型是____________。
(3)已知: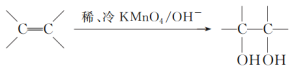 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式___________。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式___________。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式__________________。
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示.已知活性炭对重金属离子具有一定的吸附作用.
(1)当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+ , 其原因是 .
(2)当铁炭混合物中铁的质量分数相同时,Cu2+的去除率比Pb2+的高,其主要原因是 .
(3)纳米铁粉可用于处理地下水中的污染物.
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4﹣(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4﹣ , 其离子方程式为 .
②纳米铁粉与水中NO3﹣反应的离子方程式为 4Fe+NO3﹣+10H+═4Fe2++NH4++3H2O 研究发现,若pH偏低将会导致NO3﹣的去除率下降,其原因是 . 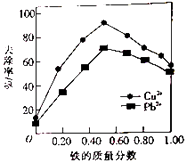
查看答案和解析>>
科目: 来源: 题型:
【题目】能在溶液中大量共存的一组离子是
A. Cu2+、SO42-、OH-、K+B. Na+、CO32-、H+、Cl-
C. H+、Cl-、NO3-、Ba2+D. Ba2+、H+、SO42-、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂.
(1)磷元素位于元素周期表第_周期_族.AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为 .
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:
CuSO4+PH3+H2O═ Cu3P↓+H3PO4+H2SO4
(3)工业制备PH3的流程如图所示.
①黄磷和烧碱溶液反应的化学方程式为 , 次磷酸属于(填“一”“二”或“三”)元酸.
②若起始时有1molP4参加反应,则整个工业流程中共生成 mol PH3 . (不考虑产物的损失)
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.
(1)B2A2是有机合成工业的一种原料. (i)将B2A2通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀.[Cu(NH3)2]Cl中存在的化学键的类型有 , Cu+基态核外电子排布式为 .
(ii)B2A2与ABC反应可得丙烯腈(H2C=CH﹣C≡N).ABC分子的构型是 . 丙烯腈分子中碳原子轨道杂化类型是
(2)工业上用EB2与A2D反应生成B2A2 . (i)EB2中的B22﹣与D22+互为等电子体,D22+的电子式可表示为;1mol D22+中含有的π键数目为 .
(ii)工业制B2A2的原料(EB2、A2D)以及产物(B2A2)的沸点从高到低排序,其顺序为(用化学式表示),其理由为 .
(iii)EB2晶体的晶胞结构与NaCl晶体的相似(如图所示),但EB2晶体中含有的中哑铃形B22﹣的存在,使晶胞沿一个方向拉长,晶胞的边长分别为0.387nm、0.387nm、0.637nm.EB2晶体中,阳离子的配位数为 , 距离最近的两个阳离子之间的距离为nm(保留3位有效数字),EB2的密度g/cm3(列式即可).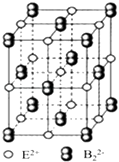
查看答案和解析>>
科目: 来源: 题型:
【题目】苯的同系物中,有的侧链能被KMnO4酸性溶液氧化,生成芳香酸,反应如下:
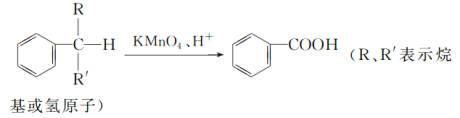
(1)现有苯的同系物甲、乙,分子式都是C10H14,甲不能被KMnO4酸性溶液氧化为芳香酸,它的结构简式是______________;乙能被KMnO4酸性溶液氧化为分子式为C8H6O4的芳香酸,则乙可能的结构有________种。
(2)有机物丙也是苯的同系物,分子式也是C10H14,它的苯环上的一溴代物只有一种,试写出丙所有可能的结构简式:___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗等物质的量浓
度的AgNO3溶液的体积比为1:1:1,则上述溶液的体积比为 ( )
A. 6:3:2 B. 3:2:1 C. 1:1:1 D. 9:3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com