
科目: 来源: 题型:
【题目】氯元素在自然界有 35Cl 和 37Cl 两种同位素,在计算式 34.969×75.77%+36.966×24.23% =35.453( )
A. 75.77%表示 35Cl 的质量分数 B. 24.23%表示 35Cl 的丰度
C. 35. 453 表示氯元素的相对原子质量 D. 36.966 表示 37Cl 的质量数
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.实验室制备Cl2可用排饱和食盐水集气法收集
C.液氯、氯水均为含多种分子和离子的混合物
D.1.12 L Cl2含有1.7NA个质子(NA表示阿伏加德罗常数)
查看答案和解析>>
科目: 来源: 题型:
【题目】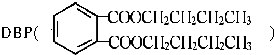 是一种常见的塑化剂,
是一种常见的塑化剂,
可由乙烯和邻二甲苯合成.
已知: 
DBP的合成过程如下: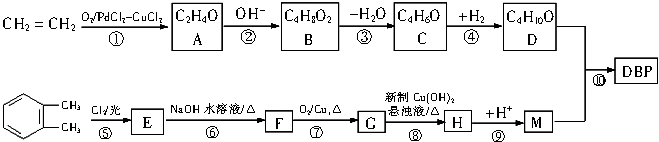
(1)D中含有的官能团名称是 , M的分子式是 .
(2)写出反应类型:反应③;反应(5) .
(3)写出结构简式A、 F .
(4)化合物B有多种同分异构体,如果这种同分异构体能与NaHCO3溶液反应生成气体,在核磁共振氢谱中只有3处吸收峰,写出其结构简式 .
(5)写出反应⑧、⑩的化学方程式
⑧
⑩ .
查看答案和解析>>
科目: 来源: 题型:
【题目】砹是原子序数最大的卤族元素,推测砹及其化合物最不可能具有的性质是( )
A. 砹是白色固体 B. HAt 很不稳定
C. AgAt 不溶于水 D. 砹易溶于某些有机溶剂
查看答案和解析>>
科目: 来源: 题型:
【题目】相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )。
①它们所含的分子数目之比为1∶1; ②它们所含的O原子数目之比为1∶2; ③它们所含的原子总数目之比为2∶3; ④它们所含的C原子数目之比为1∶1;⑤它们所含的电子数目之比为7∶11
A. ①②③④B. ②和③C. ④和⑤D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2.
8Cu+4FeO+2Fe2O3+16SO2.
(1)若CuFeS2中Fe的化合价为+2,反应中被还原的元素是__(填元素符号).
(2)用稀H2SO4浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验溶液中存在Fe3+的方法是__(注明试剂、现象).
(3)上述冶炼过程产生大量SO2.下列处理方案中合理的是__(填代号)
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(4)验证黄铜矿冶炼铜的反应后气体中含有SO2的方法是__.
(5)实验室制备,收集干燥的SO2,所需仪器如下.

①其中装置A产生SO2,反应的化学方程式为__.
②请按气流方向连接各仪器接口,顺序为a→__→ → → f,装置E中NaOH溶液的作用是__.E中反应的离子方程式__.
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识填空
(1)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.已知:SeO2在常温下是白色的晶体,熔点为340﹣350℃,则SeO2晶体属于晶体,SeO2中Se原子采取的杂化类型为
(2)卤素单质及其化合物在工农业生产和生活中都有重要的用途.
①同主族元素的电负性大小存在一定的规律,卤族元素(F、Cl、Br、I)中,电负性最小的是 , 基态Br原子的价电子排布为 .
②硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3NH3 . BF3分子的分子构型为 , BF3NH3中BF3与NH3之间通过结合(填“离子键”、“配位键”或“氢键”).
(3)某金属是抗癌药物中的明星元素,其晶体中金属原子的堆积方式如图所示.该晶胞中金属原子的配位数为 , 若已知金属的摩尔质量为Mg/mol,原子半径为rpm,阿伏加德罗常数为NA , 则该晶胞的密度为g/cm3 . (用含M、NA、则的代数式表示,1pm=1.0X10﹣10cm) 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com