
科目: 来源: 题型:
【题目】某混合气体由两种气态烃组成,2.24L该混合气体完全燃烧后,得到4.48L二氧化碳(气体体积已折算为标准状况时的体积)和3.6g水,则两种气态烃可能是( )
A.CH4和C3H8
B.C2H4和C2H6
C.CH4和C3H4
D.C2H4和C3H4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 钠与水反应:Na+2H2O= Na+ +2OH- + H2↑
B. 硅酸钠溶液与醋酸溶液混合:SiO32- + 2H+= H2SiO3↓
C. 0.01mol/L NH4Al(SO4)2 溶液与0.02mol/L Ba(OH)2 溶液等体积混合:
NH4+ +Al3 + +2SO42- +2Ba2+ +4OH- = 2BaSO4 ↓+Al(OH)3 ↓+ NH3·H2O
D. 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ = Fe3+ +3NO2↑+3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】以下对于化学键的理解中,正确的是( )
A.化学键是分子(或晶体)内相邻的两个或多个原子(或离子)之间强烈的作用力
B.化学键存在于任何分子内
C.化学键只存在于离子化合物和共价化合物中
D.氢键和范德华力也是一种化学键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是有( )
①Si ![]() Na2SiO3(aq)
Na2SiO3(aq) ![]() H2SiO3
H2SiO3
②S ![]() SO3
SO3 ![]() H2SO4
H2SO4
③Na ![]() Na2O2 NaOH
Na2O2 NaOH
④饱和NaCl(aq) ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
⑤MgCl2(aq) ![]() MgCl26H2O
MgCl26H2O ![]() Mg
Mg
⑥Al2O3 ![]() NaAlO2
NaAlO2 ![]() Al(OH)3
Al(OH)3
⑦Fe2O3 FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
⑧CuSO4(aq) ![]() Cu(OH)2
Cu(OH)2 ![]() Cu2O.
Cu2O.
A.4个
B.5个
C.6个
D.7个
查看答案和解析>>
科目: 来源: 题型:
【题目】某金属与足量稀硝酸充分反应,无气体放出,再向该溶液中加入过量NaOH溶液,加热,收集到标况下气体0.224升,整个过程转移电子的物质的量为 mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】有机合成在制药工业上有着极其重要的地位.现用硝基苯制取苯胺,再用苯胺制得无色晶体乙酰苯胺(具有退热镇痛作用的药物).
①化学反应原理为: ![]()
②相关物质的物理常数
物质 | 相对分子质量 | 熔点(℃) | 沸点 | 溶解度(g) | |
水 | 乙醇 | ||||
苯胺 | 93 | ﹣6 | 184 | 3.42(20℃) | 任意比混溶 |
乙酸 | 60 | 17 | 117.9 | 任意比混溶 | 任意比混溶 |
乙酰苯胺 | 135 | 114 | 304 | 0.56(20℃) | 36.9(20℃) |
③制备乙酰苯胺的装置及过程如图所示:
已知:Ⅰ苯胺易被氧化;Ⅱ韦氏分馏柱作用与原理类似于冷凝管
请回答以下问题:
(1)加入锌粒的目的是;韦氏分馏柱作用的是;
(2)步骤1中保持柱顶温度约为105℃,则锥形瓶中收集到的馏分主要是;
(3)步骤2中将反应液倒入水中的目的是;
(4)步骤3中洗涤剂最好选择;
A.冷水
B.热水
C.15%的乙醇溶液
D.NaOH溶液
(5)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→→→抽滤→洗涤→干燥;
(6)上述制备过程的产率是 . (结果保留4位有效数字).
查看答案和解析>>
科目: 来源: 题型:
【题目】一包白色粉末,由几种常见的盐混合组成,其中可能含有Na+、K+、Al3+、CO32﹣、HCO3﹣、SO42﹣、SO32﹣、NO2﹣中的若干种离子.某同学对该溶液进行如下实验: 
以下说法正确的是( )
A.白色沉淀甲是Al(OH)3 , 气体甲是CO2 , 所以混合物一定含Al3+和HCO3﹣
B.气体乙一定是NO和NO2的混合气体
C.白色沉淀乙是BaSO4 , 所以原混合物一定含有SO42﹣
D.焰色反应为黄色火焰,不能确定原混合物中不含K+
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件. 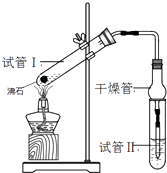
物质 | 沸点/°C | 密度/gcm﹣3 |
乙醇 | 78.0 | 0.79 |
乙酸 | 117.9 | 1.05 |
乙酸乙酯 | 77.5 | 0.90 |
异戊醇 | 131 | 0.8123 |
乙酸异戊酯 | 142 | 0.8670 |
实验步骤如下:
①配制反应混合液:2mL浓H2SO4、3mL乙醇、2mL乙酸
②按图连接实验装置并检验气密性
③分别在试管1、试管2中加入反应液
④用酒精灯微热3min,再加热使之微微沸腾3min
⑤分离提纯乙酸乙酯
(1)在试管1中加入物质分别是:(按着加入的先后顺序写出名称),乙醇过量的目的是:;
(2)该反应的平衡常数表达式K=;
(3)试管Ⅱ中所盛试剂为 , 欲将其物质分离使用的仪器为 , 在充分振荡的过程中,发生的反应为;
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和mol/L;
②分析实验(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是;
(5)若利用该装置制备乙酸异戊酯,产物将主要在装置中的得到,那么产率会(“较高”或“偏低”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com