
科目: 来源: 题型:
【题目】将铜加入一定量稀硫酸和过氧化氢混合溶液中,充分反应后,溶液呈蓝色,有无色气体产生;若还发现容器底部有少量固体,则该固体可能是
A.CuB.SC.CuSD.Cu2S
查看答案和解析>>
科目: 来源: 题型:
【题目】用标准盐酸溶液滴定未知浓度的NaOH溶液,所测数据如下:
滴定 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.20 | 20.22 |
第二次 | 25.00 | 0.56 | 24.54 |
第三次 | 25.00 | 0.42 | 20.40 |
测得NaOH溶液的物质的量浓度为( )
A.0.0853mol/L
B.0.1000mol/L
C.0.0800mol/L
D.0.1250mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】已知298K,1.01×105Pa条件下:2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1;CO(g)+ ![]() O2(g)═CO2(g)△H=﹣282.9kJmol﹣1则该条件下CO(g)+H2O(g)═H2(g)+CO2(g)的反应热是( )
O2(g)═CO2(g)△H=﹣282.9kJmol﹣1则该条件下CO(g)+H2O(g)═H2(g)+CO2(g)的反应热是( )
A.﹣41.1 kJmol﹣1
B.+200.7 kJmol﹣1
C.﹣766.5 kJmol﹣1
D.+41.1 kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:
2Fe+3Br2═2FeBr3 , 2FeBr3 ![]() 2FeBr2+Br2↑,
2FeBr2+Br2↑,
最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.
请回答:
(1)仪器d的名称 .
(2)导入的CO2不干燥,会在E中发生副反应,其含铁副产物为;若所得产物中含此副产物,用化学方法检验.下列方案合理的是 .
A.取少量产物于试管中加入稀盐酸,再加入KSCN溶液
B.取少量产物于硬质大试管中,通入氢气,排尽空气后加热,用CuSO4检验生成的水蒸气
C.用磁铁吸引,看产物能否被吸引
D.取少量产物于试管中加入蒸馏水,过滤看是否有黑色不溶物
(3)为防止污染空气,实验时应在F处连接盛有NaOH溶液的尾气吸收装置,反应的化学方程式: .
(4)取产品10g配制成250mL溶液,取出25.00mL用酸性KMnO4溶液滴定溶液中的Fe2+ , 用去0.03000mol/L酸性KMnO4溶液25.00mL,则产品的纯度为 .
(5)利用除去杂质后的FeBr2可以验证Cl2、Fe3+、Br2的氧化性强弱.将你设计的实验操作、预计的实验现象和实验结论(氧化性强弱)填写在下列表空格内:
实验操作 | 实验现象 | 氧化性强弱 |
① | 溶液呈血红色 | ② |
③ | ④ | Cl2>Br2 |
查看答案和解析>>
科目: 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为( )
A.920kJ
B.557kJ
C.436kJ
D.188kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
ⅠCO(g)+2H2(g)CH3OH(g)△H1
ⅡCO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2=﹣58kJ/mol
ⅢCO2(g)+H2(g)CO(g)+H2O(g)△H3
回答下列问题:
(1)物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热.即化学反应热:△H=生成物标准生成热综合﹣反应物标准生成热总和.
已知四种物质的标准生成热如表:
物质 | CO | CO2 | H2 | CH3OH(g) |
标准生成热(kJ/mol) | ﹣110.52 | ﹣393.51 | 0 | ﹣201.25 |
A.计算△H1=kJ/mol B.△H30(填=、<、>)
(2)由甲醇在一定条件下制备甲醚.一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g).实验数据见表:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
b | 387 | 0.40 | 0 | 0 | ||
c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正反应为放热反应
B.达到平衡时,容器a中的CH3OH体积分数比容器b中的小
C.容器a中反应到达平衡所需时间比容器c中的长
D.若起始时向容器a中充入CH3OH 0.15mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
(3)合成气的组成 ![]() =2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示.
=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示.
①α(CO)值随温度升高而(填“增大”或“减小”),其原因是 .
②图中P1、P2、P3的大小关系为 , 其判断理由是 .
(4)甲醇可以制成燃料电池,与合成气制成燃料电池相比优点是:;若以硫酸作为电解质其负极反应为: . 
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是( )

①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ①②③④⑤ B. ②④ C. ①③⑤ D. ①②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯.从该回收料中回收硒的工艺流程如图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2): 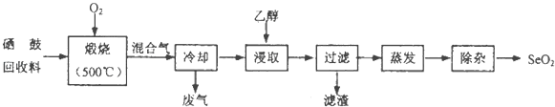
部分物质的物理性质如表:
物质 | 熔点 | 沸点 | 溶解度 |
SeO2 | 340℃(315℃升华) | 684℃ | 易溶于水和乙醇 |
TeO2 | 733℃(450℃升华) | 1260℃ | 微溶于水,不溶于乙醇 |
回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为;H2Se的热稳定性比H2S的热稳定性(填“强”或“弱”).
(2)乙醇浸取后过滤所得滤渣的主要成分是 . 蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是 .
(3)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式 .
(4)已知H2SeO3的电离常数K1=3.5×10﹣3、K2=5.0×10﹣8 , 回答下列问题:
①Na2SeO3溶液呈性,原因是(用离子方程式表示);
②在Na2SeO3溶液中,下列关系式正确的是:
A.c(Na+)+c(H+)=c(SeO32﹣)+c(HSeO3﹣)+c(OH﹣)
B.2c(Na+)=c(SeO32﹣)+c(HSeO3﹣)+c(H2SeO3)
C.c(Na+)=2c(SeO32﹣)+2c(HSeO3﹣)+2c(H2SeO3)
D.c(OH﹣)=c(H+)+c(HSeO3﹣)+c(H2SeO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】A﹣I是中学化学常见的九种物质,A﹣I之间的转化关系如图所示. 
已知化合物A的焰色反应显黄色,C、D、E是气态单质,F、H是气态化合物,两者在通常状况下反应产生大量白烟.请回答下列问题:
(1)写出I的电子式;
(2)写出电解A溶液的离子反应方程式;
(3)以F、空气和水为原料经过一系列的化学反应可以合成酸M,M的浓溶液与铜反应产生红棕色气体,写出M的浓溶液与铜反应的化学方程式 .
(4)G的溶液可使Mg(OH)2悬浊液溶解.若Mg(OH)2饱和溶液中的c(Mg2+)=0.18mol/L,则溶液的pH是 . (已知:Ksp[Mg(OH)2]=1.8×10﹣11mol/L)
查看答案和解析>>
科目: 来源: 题型:
【题目】在杠杆的两端分别挂着质量和体积都相同的空心铝球和铜球,此时杠杆平衡。然后将两球分别浸没在氢氧化钠溶液和硫酸铁溶液中片刻,如图,则下列说法正确的是( )

A. 在浸没过程中,杠杆始终保持平衡 B. 两边烧杯中的溶液质量均增加了
C. 两烧杯中均无气泡产生 D. 右边铜球质量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com